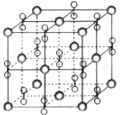
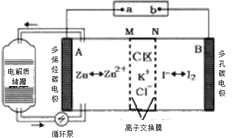
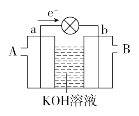
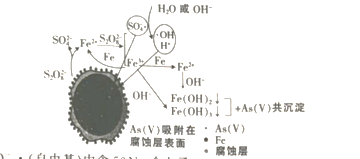
题目内容
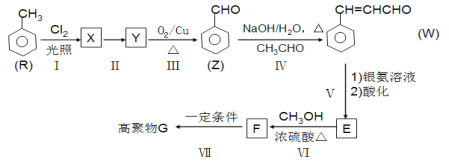
【题目】有机物 K 是某药物的中间体,合成路线如图所示:
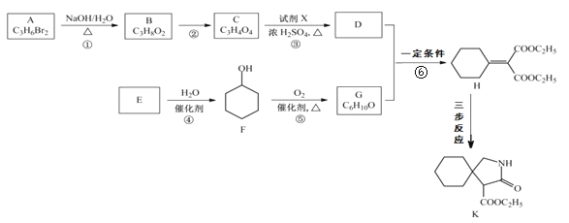
已知:i.R-CN![]() R-CH2-NH2
R-CH2-NH2
ii.R1-NH2+R2COOC2H5![]()
![]() +C2H5OH
+C2H5OH
回答下列问题
(1)A 的名称是_______。
(2)反应①的化学方程式是_____。
(3)反应②的类型是_____。
(4)反应③中的试剂 X是_____。
(5)E 属于烃,其结构简式是_____。
(6)H 中所含的官能团是_____。
(7)反应⑥的化学方程式是_____。
(8)H 经三步反应合成 K:H![]() I→J→K,写出中间产物 I和J的结构简式_____。
I→J→K,写出中间产物 I和J的结构简式_____。
【答案】1,3-二溴丙烷 Br-CH2-CH2-CH2-Br+2NaOH![]() HO-CH2-CH2-CH2-OH+2NaBr 氧化反应 C2H5OH
HO-CH2-CH2-CH2-OH+2NaBr 氧化反应 C2H5OH 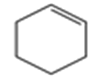 碳碳双键、酯基
碳碳双键、酯基 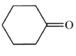 +C2H5OOC-CH2-COOC2H5
+C2H5OOC-CH2-COOC2H5![]()
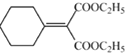 +H2O
+H2O 

【解析】
E属于烃,E与水反应生成![]() ,则E为
,则E为![]() ;F发生催化氧化生成G为
;F发生催化氧化生成G为![]() ,由H的结构可知D为二元酯,C到D为酯化反应,可知C为二元酸、X为C2H5OH,故A为BrCH2CH2CH2Br、B为HOCH2CH2CH2OH、C为HOOCCH2COOH,则D为C2H5OOCCH2COOC2H5。
,由H的结构可知D为二元酯,C到D为酯化反应,可知C为二元酸、X为C2H5OH,故A为BrCH2CH2CH2Br、B为HOCH2CH2CH2OH、C为HOOCCH2COOH,则D为C2H5OOCCH2COOC2H5。
(1)根据分析可知A为BrCH2CH2CH2Br,A的名称是:1,3-二溴丙烷;
(2)反应①为卤代烃的取代反应,化学方程式是: ;
;
(3)反应②是羟基转化为羧基,属于氧化反应;
(4)由分析可知,反应③中的试剂X是:C2H5OH;
(5)E属于烃,E与水反应生成![]() ,则E为
,则E为![]() ;
;
(6)由结构可知H中所含的官能团是:碳碳双键、酯基;
(7)根据D的结构简式和G的结构简式可知反应⑥的化学方程式是: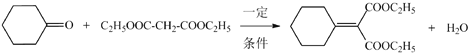 ;
;
(8)对比H与K的结构,H与HCN发生加成反应生成I为 ,然后还原生成J为
,然后还原生成J为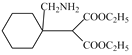 ,最后发生取代反应脱去1分子C2H5OH生成K。
,最后发生取代反应脱去1分子C2H5OH生成K。

 走进文言文系列答案
走进文言文系列答案【题目】Ⅰ.能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
已知:C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1
H2(g)+![]() O2(g)===H2O(g) ΔH2=-241.8 kJ·mol-1
O2(g)===H2O(g) ΔH2=-241.8 kJ·mol-1
CO(g)+![]() O2(g)===CO2(g) ΔH3=-283.0 kJ·mol-1
O2(g)===CO2(g) ΔH3=-283.0 kJ·mol-1
则煤气化主要反应C(s)+H2O(g)=CO(g)+H2(g)的ΔH=____________________。
Ⅱ.为了减少CO的排放,某环境研究小组以CO和H2为原料合成清洁能源二甲醚(DME),反应如下:4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g) ΔH=-198 kJ·mol-1。
CH3OCH3(g)+H2O(g) ΔH=-198 kJ·mol-1。
(1)如图所示能正确反映平衡常数K随温度变化关系的曲线为________(填曲线标记字母),其判断理由是____________。

(2)在一定温度下,向2.0 L固定容积的密闭容器中充入2 mol H2和1 mol CO,经过一段时间后,反应4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g)达到平衡。反应过程中测得的部分数据见下表:
CH3OCH3(g)+H2O(g)达到平衡。反应过程中测得的部分数据见下表:
时间/min | 0 | 20 | 40 | 80 | 100 |
n(H2)/mol | 2.0 | 1.4 | 0.85 | 0.4 | — |
n(CO)/mol | 1.0 | — | 0.425 | 0.2 | 0.2 |
n(CH3OCH3)/mol | 0 | 0.15 | — | — | 0.4 |
n(H2O)/mol | 0 | 0.15 | 0.2875 | 0.4 | 0.4 |
①0~20 min的平均反应速率v(CO)=__________________mol·L-1·min-1;
②达到平衡时,H2的转化率为__________________;
③在上述温度下,该反应的平衡常数K=______________________;
④能表明该反应达到平衡状态的是________(填序号);
A CO的转化率等于H2O的产率 B 混合气体的平均相对分子质量不变
C v(CO)与v(H2)的比值不变 D 混合气体的密度不变
⑤在上述温度下,向平衡后的2 L容器中再充入0.4 mol H2和0.4 mol CH3OCH3(g),则化学平衡________移动(填“向左”“向右”或“不”)。