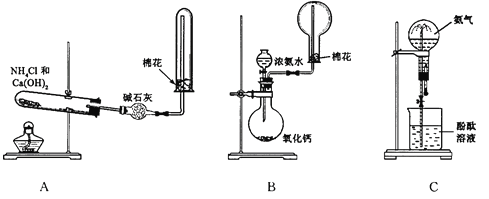
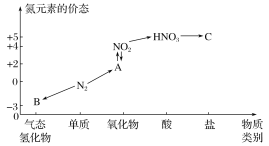
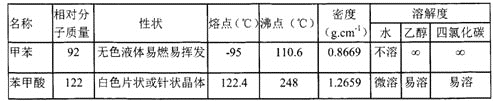
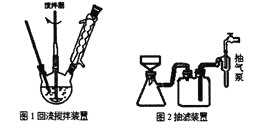
题目内容
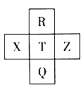
【题目】元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R为元素周期表中的电负性最强的元素。则下列判断正确的是( )
A.非金属性:Z<T<X
B.R与Q的电子数相差24
C.气态氢化物的沸点:R<T<Q
D.最高价氧化物的水化物的酸性:T>Q
【答案】D
【解析】
R为元素周期表中的电负性最强的元素,则R是F元素,根据元素R、X、T、Z、Q在元素周期表中的相对位置知,X是S元素、T是Cl元素、Z是Ar元素、Q是Br元素;
A.同一周期元素,元素的非金属性随着原子序数的增大而增强,但稀有气体较稳定,所以非金属性T>X>Z,故A错误;
B.R是F元素,核外电子数为9,Q是Br元素,核外电子数为35,相差35-9=26,故B错误;
C.R是F元素,T是Cl元素、Q是Br元素,属于同主族元素,氢化物的组成和结构相似,沸点随着相对分子质量增大而升高,但HF分子间除了分子间作用力之外,还形成氢键,沸点反常,故三者的气态氢化物的沸点是R>Q>T,故C错误;
D.T是Cl元素、Q是Br元素,T、Q属于同主族元素,从上往下,非金属依次减弱,非金属性T>Q,即Cl>Br,非金属性越强,最高价氧化物的水化物的酸性越强,则最高价氧化物的水化物的酸性:T>Q,故D正确;
答案为D。

练习册系列答案
相关题目