题目内容
【题目】硫酰氯(SO2Cl2)可用于有机合成和药物制造等。实验室利用SO2和Cl2在活性炭作用下制取SO2Cl2[SO2(g)+Cl2(g)![]() SO2Cl2(l) ΔH= -97.3kJ/mol],装置如图所示(部分装置省略)。已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,遇水能发生剧烈反应并产生白雾。下列说法错误的是
SO2Cl2(l) ΔH= -97.3kJ/mol],装置如图所示(部分装置省略)。已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,遇水能发生剧烈反应并产生白雾。下列说法错误的是
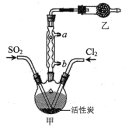
A.乙装置中盛放的试剂是P2O5,防止水蒸气进入装置中
B.装置甲应置于冰水浴中,目的是提高SO2Cl2产率
C.反应结束后,分离甲中混合物的实验操作是蒸馏
D.SO2、Cl2均可使品红试液褪色,原理不相同
【答案】A
【解析】
SO2Cl2沸点低、易挥发,根据装置图可知,三颈烧瓶上方的仪器的名称为球形冷凝管,作用是使挥发的产物SO2Cl2冷凝回流;由于会有一部分Cl2、SO2通过冷凝管逸出,Cl2、SO2都是有毒气体,故乙中应使用碱性试剂,又因SO2Cl2遇水能发生剧烈反应并产生白雾,所以乙中盛碱石灰吸收未反应的二氧化硫、氯气,防止污染空气,并吸收空气中的水蒸气,防止进入甲中导致硫酰氯水解;活性炭有多孔结构可以增大反应物之间的接触面,提高反应速率;分离沸点不同的液体可以用蒸馏的方法。
A. 乙装置中盛放的试剂是碱石灰,吸收未反应的二氧化硫、氯气,防止污染空气,并吸收空气中的水蒸气,防止进入甲中导致硫酰氯水解,故A错误;
B. 制备硫酰氯的反应为放热反应,装置甲应置于冰水浴中,可提高SO2Cl2产率,故B正确;
C. 根据硫酰氯的熔沸点数据,反应结束后,分离沸点不同的液体可以用蒸馏的方法,所以甲中混合物分离开的实验操作是蒸馏,故C正确;
D. SO2、Cl2均可使品红试液褪色,二氧化硫可以和有机色质结合而具有漂白性,氯水中的次氯酸具有氧化性而具有漂白性,二者漂白原理不一样,故D正确;
答案选A。

【题目】用如图所示装置检验乙烯时不需要除杂的是( )
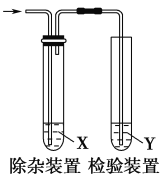
选项 | 乙烯的制备 | 试剂X | 试剂Y |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
C | C2H5OH与浓H2SO4加热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
D | C2H5OH与浓H2SO4加热至170℃ | NaOH溶液 | 溴水 |
A.AB.BC.CD.D