题目内容
【题目】“一带路”为中国化工企业开辟了新的国际市场,能源环保是基础。在能源领域科学家提出构想——富集空气中的CO2,并使之与H2反应生成可再生能源甲醇.流程如下:
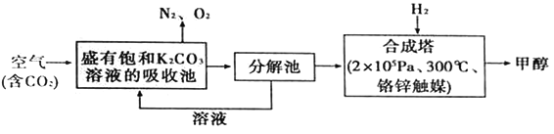
(1)在合成塔中,若有4400gCO2与足量H2完全反应,生成气态的H2O和气态甲醇,可放出5370kJ的热量,写出该反应的热化学方程式________________。
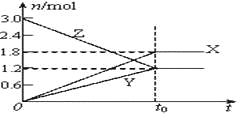
(2)一定条件下,向2L恒容密闭容器中充入1molCO2和3molH2在不同催化剂作用下发生反应I、反应II、反应III,相同时间内CO2的转化率随温度变化如图1所示:
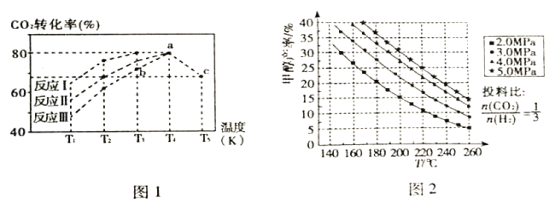
①催化效果最佳的反应是_________(填“反应I”、“反应II”、“反应III”)。
②b点反应速率v(正)______v(逆) (填“>”、“=”或“<”)。
③若此反应在a点时已达平衡状态,a点的转化率比c点高的原因是_________。
(3)选取合适的催化剂发生上述反应,测得甲醇的产率与反应温度、压强的关系如图2。
④分析图中数据可知,在220℃、5.0MPa时,CO2的转化率为________;将温度降低至140℃、压强减小至2.0MPa,CO2的转化率将_______(填“增大”、“减小”或“不变”)。
⑤200℃、2.0MPa时,将amol/LCO2和3amol/LH2充入VL密闭容器中,在催化剂作用下反应达到平衡。根据图中数据计算所得甲醇的质量______g(用含a、V的代数式表示)。
(4)用NaOH溶液吸收CO2所得饱和碳酸钠溶液可以对废旧电池中的铅膏(主要成分PbSO4)进行脱硫反应。已知Ksp(PbSO4)=1.6×10-8,Ksp(PbCO3)=7.4×10-14,PbSO4(s)+CO32-(aq)==PbCO3(s)+SO42-(aq),则该反应的平衡常数K=___(保留三位有效数字);若在其溶液中加入少量Pb(NO3)2晶体,则c(SO42-):c(CO32-)的比值将_____(填“增大”、“减小”或“不变”)。
【答案】 CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-53.7kJ/mol 反应I > 该反应为放热反应,温度升高,平衡逆向移动 25% 增大 4.8aV 2.16×105 不变
CH3OH(g)+H2O(g) △H=-53.7kJ/mol 反应I > 该反应为放热反应,温度升高,平衡逆向移动 25% 增大 4.8aV 2.16×105 不变
【解析】分析:(1)根据参加反应的CO2的物质的量结合放出的热量解答;
(2)①根据相同条件下CO2的转化率越高催化效果越好分析;
②根据b点在曲线下方转化率低分析解答;
③根据温度对平衡状态的影响分析;
(3)④根据在220℃、5.0MPa时甲醇的产率是25%计算;根据图像分析;
⑤根据在200℃、2.0MPa时甲醇的产率是1%计算;
(4)根据平衡常数的含义、影响因素结合方程式计算与判断。
详解:(1)4400gCO2的物质的量是100mol,放出的热量是5370kJ,则1molCO2完全反应放出的热量是53.70kJ,因此该反应的热化学方程式为CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-53.7kJ/mol
CH3OH(g)+H2O(g) △H=-53.7kJ/mol
(2)①根据图像可知在相同条件下反应I中CO2的转化率最高,则催化效果最佳的反应是反应I。
②b点在曲线下方,转化率低,在达到平衡的过程中CO2的转化率升高,这说明此时反应向正反应方向进行,则反应速率v(正)>v(逆)。
③由于该反应为放热反应,温度升高,平衡逆向移动,因此a点的转化率比c点高。
(3)④在220℃、5.0MPa时甲醇的产率是25%,则
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
起始量(mol) 1 3 0 0
转化量(mol) x 3x x x
平衡量(mol) 1-x 3-3x x x
由于此时甲醇的产率是25%,则x=0.25,因此CO2的转化率为3x/3×100%=25%;根据图像曲线变化可知将温度降低至140℃、压强减小至2.0MPa时甲醇的产率增大,因此CO2的转化率将增大。
⑤在200℃、2.0MPa时甲醇的产率是15%,则
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
起始量(mol) aV 3aV 0 0
转化量(mol) y 3y y y
平衡量(mol) aV-y 3aV-3y y y
此时甲醇的产率是0.15,则y=0.15aV,因此所得甲醇的质量0.15aV×32 g=4.8aV g;
(4)根据方程式可知该反应的平衡常数K=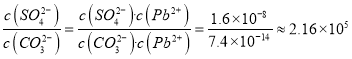 。若在其溶液中加入少量Pb(NO3)2晶体,由于平衡常数只与温度有关系,则根据该反应的平衡常数表达式可知c(SO42-):c(CO32-)的比值不变。
。若在其溶液中加入少量Pb(NO3)2晶体,由于平衡常数只与温度有关系,则根据该反应的平衡常数表达式可知c(SO42-):c(CO32-)的比值不变。