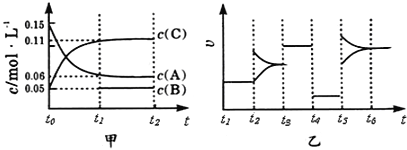
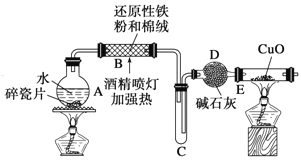
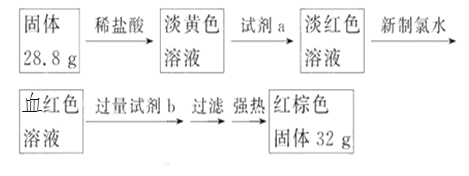
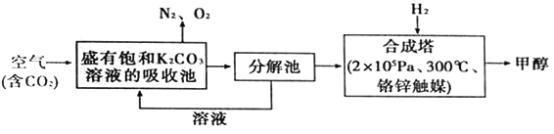
题目内容
【题目】近几年,具有超常性能的铝离子电池成为研究热点,其可在一分钟内完成充放电。铝与石墨为电极,内部用AlCl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示。下列说法错误的是
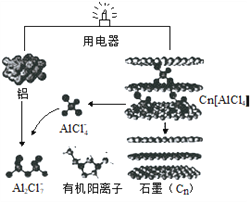
A. 放电时,有机阳离子向石墨电极方向移动
B. 放电时,正极的电极反应式为:Cn[AlCl4]+e-=Cn+AlCl4-
C. 充电时,每生成1mol铝,同时消耗4molAl2Cl7-
D. 充电时铝电极接电源负极,该极有Cn[AlCl4]生成
【答案】D
【解析】分析:A、原电池中阳离子向正极移动;
B、放电时负极发生氧化反应子,正极发生得到电子的还原反应;
C、根据充电时的电极反应式解答;
D、根据充电可以可作是放电的逆反应解答。
详解:A、铝是活泼的金属,放电时做负极,石墨做正极。原电池中阳离子向正极移动,所以有机阳离子向石墨电极方向移动,A正确;
B、放电时正极发生得到电子的还原反应,根据装置图可知正极的电极反应式为:Cn[AlCl4]+e-=Cn+AlCl4-,B正确;
C、充电时铝电极作阴极,发生得到电子的还原反应,电极反应式为4Al2Cl7-+3e-=Al+7AlCl4-,因此充电时,每生成1mol铝,同时消耗4molAl2Cl7-,C正确;
D、放电时,铝是活泼的金属铝是负极,因此充电时铝电极接电源负极,电极反应式为4Al2Cl7-+3e-=Al+7AlCl4-,因此该极有AlCl4-生成,石墨电极有Cn[AlCl4]生成,D错误;答案选D。

练习册系列答案
相关题目