题目内容
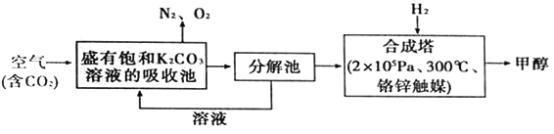
【题目】海洋是资源宝库。下图是工业上对海水的一种综合利用的流程图:

请回答下列问题:
(1) 在实验室对海水进行过滤,所需要玻璃仪器为烧杯、漏斗和_________。
(2) 若粗盐中含有Ca2+、Mg2+、SO42-三种杂质离子。精制提纯时,备用的除杂试剂有:A.盐酸,B.Na2CO3溶液,C.NaOH溶液,D.BaCl2溶液。请你正确排列加入试剂的顺序:NaOH溶液、_______、_______、_______(填编号)。
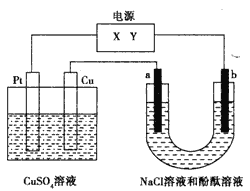
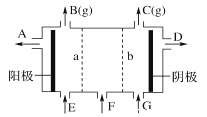
(3) 用如图电解食盐水,石墨电极上产生的气体为_______;在铁棒周围的溶液里滴加酚酞试剂,溶液变_______色;小烧杯中NaOH溶液的作用是(用化学方程式表示):______________。

(4)在盛有Mg(OH)2固体的烧杯中,加入足量盐酸,待固体全部溶解后,要从溶液中获取MgCl2·6H2O晶体,需要进行的实验操作依次为_________________(填编号)。
A.蒸馏 B.蒸发 C.冷却结晶 D.过滤
【答案】玻璃棒 D B A 氯气( Cl2) 红 Cl2+NaOH=NaCl+NaClO+H2O BCD
【解析】
(1)在实验室对海水进行过滤,所需要玻璃仪器为烧杯、漏斗和玻璃棒,玻璃棒在过滤操作中起到引流的作用, 因此答案是:玻璃棒。
(2)粗盐中含有Ca2+、Mg2+、SO42-三种杂质离子。精制提纯时:先加NaOH溶液除去Mg2+、再加BaCl2溶液除去SO42-、再加Na2CO3溶液除去Ca2+和过量Ba2+;过滤后加入盐酸除去过量的NaOH和碳酸钠;加入试剂的顺序:D;B;A。
(3) 用如图电解食盐水,石墨电极为阳极,电极上产生的气体为Cl2;铁棒与电源负极相连,发生的反应为:2H2O+4e-= H2![]() +2OH-,如果在周围的溶液里滴加酚酞试剂,溶液变红色;小烧杯中NaOH溶液的作用是吸收氯气,反应化学方程式Cl2+2NaOH=NaCl+NaClO+H2O。答案:氯气;红;Cl2+2NaOH=NaCl+NaClO+H2O。
+2OH-,如果在周围的溶液里滴加酚酞试剂,溶液变红色;小烧杯中NaOH溶液的作用是吸收氯气,反应化学方程式Cl2+2NaOH=NaCl+NaClO+H2O。答案:氯气;红;Cl2+2NaOH=NaCl+NaClO+H2O。
(4)先通过蒸发去除多余的水分,然后冷却结晶,再过滤得到晶体,进行洗涤干燥。答案:BCD。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案【题目】工业从废铅酸蓄电池的渣泥(主要成分为PbSO4、PbO2)回收铅。RSR 工艺的主要流程如下:
![]()
(1)铅酸蓄电池放电时总反应为:
Pb(s) + PbO2(s) + 2H2SO4(aq) = 2PbSO4(s) + 2H2O(l)
正极反应:PbO2(s) + SO42-(aq) + 4H+(aq) + 2e- = PbSO4(s) + 2H2O(l)
负极反应:________。
(2)向渣泥中加入Na2CO3溶液将PbSO4转化为更难溶的PbCO3。
①用化学平衡移动原理解释其原因:________。
②工业上常用NaHCO3溶液代替Na2CO3溶液,将PbSO4转化为PbCO3。PbSO4与NaHCO3溶液或Na2CO3溶液不同物质的量比时,PbSO4的转化率见下表。
Ⅰ | n(PbSO4)∶ n(NaHCO3) | 1∶1.5 | 1∶2 | 1∶3 |
PbSO4转化率/% | 95.5 | 96.9 | 97.8 | |
Ⅱ | n(PbSO4)∶ n(Na2CO3) | 1∶1.5 | 1∶2 | 1∶3 |
PbSO4转化率/% | 98 | 98 | 98 |
依据上表数据,物质的量比相同时,Ⅱ中PbSO4的转化率比Ⅰ中的略大,原因是________。
③上述反应除生成PbCO3外,还可能生成碱式碳酸铅[2PbCO3·Pb(OH)2],二者受热都易分解生成PbO。通过实验确定产物中含有2PbCO3·Pb(OH)2,则该实验操作及现象是________;通过定量实验确定产物中2PbCO3·Pb(OH)2的含量,则需测定的数据是________。
(3)渣泥中加入Na2SO3溶液,利用其性质是________。
(4)H2SiF4溶液溶解PbCO3的化学方程式是________。