题目内容
【题目】下列各组离子一定能大量共存的是( )
①“84”消毒液的水溶液中:Fe2+、Cl-、Ca2+、Na+
②加入KSCN显红色的溶液:K+、NH![]() 、Cl-、S2-
、Cl-、S2-
③能够与金属Cu常温下反应放出气体的溶液:Fe3+、Al3+、SO![]() 、K+
、K+
④pH=2的溶液中:NH![]() 、Na+、Cl-、Cu2+
、Na+、Cl-、Cu2+
⑤由水电离出的c(OH-)=1×10-13molL-1的溶液中Mg2+、Ba2+、Cl-、Br-
A.②③B.①③C.①⑤D.③④
【答案】D
【解析】
①“84”消毒液的水溶液中含有具有强氧化性的ClO-会氧化Fe2+,故①不合题意;
②加入KSCN显红色的溶液中存在Fe3+将氧化S2-,故②不合题意;
③能够与金属Cu常温下反应放出气体的溶液中含有H+和![]() 与Fe3+、Al3+、SO
与Fe3+、Al3+、SO![]() 、K+均能大量共存,故③符合题意;
、K+均能大量共存,故③符合题意;
④pH=2的溶液中NH![]() 、Na+、Cl-、Cu2+均能大量共存,故④符合题意,
、Na+、Cl-、Cu2+均能大量共存,故④符合题意,
⑤由水电离出的c(OH-)=1×10-13molL-1的溶液可能是强碱性溶液,也可以是强酸性溶液,当时强碱性溶液是Mg2+不能大量存在,故⑤不符合题意;故只有③④符合题意;
故答案为:D

 名师点拨卷系列答案
名师点拨卷系列答案【题目】为了降低电子垃圾对环境构成的影响,将一批废弃的线路板简单处理后,得到含![]() 、
、![]() 、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
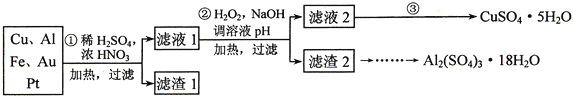
方法Ⅰ | 用炭粉在高温条件下还原CuO |
方法Ⅱ | 电解法: |
方法Ⅲ | 用肼 |
![]() 第
第![]() 步Cu与混酸反应的离子方程式为______
步Cu与混酸反应的离子方程式为______![]() 得到滤渣1的主要成分为______。
得到滤渣1的主要成分为______。
![]() 第
第![]() 步中加入
步中加入![]() 的作用是______,使用
的作用是______,使用![]() 的优点是______;调溶液pH的目的是______。
的优点是______;调溶液pH的目的是______。
![]() 简述第
简述第![]() 步由滤液2得到
步由滤液2得到![]() 的方法是______。
的方法是______。
![]() 由滤渣2制取
由滤渣2制取![]() ,设计了以下三种方案:
,设计了以下三种方案:
甲:滤渣![]() 酸浸液
酸浸液![]() Al2(SO4)3﹒18H2O
Al2(SO4)3﹒18H2O
乙:滤渣![]() 酸浸液
酸浸液![]() 滤液
滤液![]() Al2(SO4)3﹒18H2O
Al2(SO4)3﹒18H2O
丙:滤渣2![]() 滤液
滤液![]() 溶液
溶液![]() Al2(SO4)3﹒18H2O
Al2(SO4)3﹒18H2O
上述三种方案中,______方案不可行,原因是______;从原子利用率角度考虑,______方案更合理。
![]() 用滴定法测定
用滴定法测定![]() 含量.取ag试样配成100mL溶液,每次取
含量.取ag试样配成100mL溶液,每次取![]() ,消除干扰离子后,用c
,消除干扰离子后,用c![]()
![]() 标准溶液滴定至终点,平均消耗EDTA溶液b
标准溶液滴定至终点,平均消耗EDTA溶液b![]() 滴定反应如下:
滴定反应如下:![]() 写出计算
写出计算![]() 质量分数的表达式
质量分数的表达式![]() ______。
______。

