题目内容
【题目】为了降低电子垃圾对环境构成的影响,将一批废弃的线路板简单处理后,得到含![]() 、
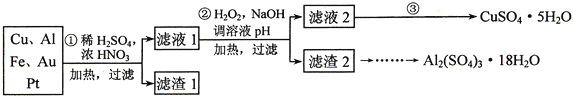
、![]() 、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
方法Ⅰ | 用炭粉在高温条件下还原CuO |
方法Ⅱ | 电解法: |
方法Ⅲ | 用肼 |
![]() 第
第![]() 步Cu与混酸反应的离子方程式为______
步Cu与混酸反应的离子方程式为______![]() 得到滤渣1的主要成分为______。
得到滤渣1的主要成分为______。
![]() 第
第![]() 步中加入
步中加入![]() 的作用是______,使用
的作用是______,使用![]() 的优点是______;调溶液pH的目的是______。
的优点是______;调溶液pH的目的是______。
![]() 简述第
简述第![]() 步由滤液2得到
步由滤液2得到![]() 的方法是______。
的方法是______。
![]() 由滤渣2制取
由滤渣2制取![]() ,设计了以下三种方案:
,设计了以下三种方案:
甲:滤渣![]() 酸浸液
酸浸液![]() Al2(SO4)3﹒18H2O
Al2(SO4)3﹒18H2O
乙:滤渣![]() 酸浸液
酸浸液![]() 滤液
滤液![]() Al2(SO4)3﹒18H2O
Al2(SO4)3﹒18H2O
丙:滤渣2![]() 滤液
滤液![]() 溶液
溶液![]() Al2(SO4)3﹒18H2O
Al2(SO4)3﹒18H2O
上述三种方案中,______方案不可行,原因是______;从原子利用率角度考虑,______方案更合理。
![]() 用滴定法测定
用滴定法测定![]() 含量.取ag试样配成100mL溶液,每次取
含量.取ag试样配成100mL溶液,每次取![]() ,消除干扰离子后,用c
,消除干扰离子后,用c![]()
![]() 标准溶液滴定至终点,平均消耗EDTA溶液b
标准溶液滴定至终点,平均消耗EDTA溶液b![]() 滴定反应如下:
滴定反应如下:![]() 写出计算
写出计算![]() 质量分数的表达式
质量分数的表达式![]() ______。
______。
【答案】![]() 或
或![]() Au、Pt 将
Au、Pt 将![]() 氧化为
氧化为![]() 过氧化氢做氧化剂不引入杂质,对环境无污染 使
过氧化氢做氧化剂不引入杂质,对环境无污染 使![]() 、
、![]() 沉淀除去 加热滤液2,经过蒸发、冷却、结晶、过滤,最终制得硫酸铜晶体 甲 所得产品中含有较多
沉淀除去 加热滤液2,经过蒸发、冷却、结晶、过滤,最终制得硫酸铜晶体 甲 所得产品中含有较多![]() 杂质 乙
杂质 乙 ![]()
【解析】
含![]() 、
、![]() 、4%Fe及少量Au、Pt等金属的混合物加入混酸加热过滤,铜反应生成铜盐溶液,Au、Pt不与混酸反应,所以滤渣的主要成分是Au、Pt,滤液1中的离子是
、4%Fe及少量Au、Pt等金属的混合物加入混酸加热过滤,铜反应生成铜盐溶液,Au、Pt不与混酸反应,所以滤渣的主要成分是Au、Pt,滤液1中的离子是![]() 、
、![]() 、
、![]() ,加入过氧化氢氧化亚铁离子为铁离子,调节溶液PH的目的是使
,加入过氧化氢氧化亚铁离子为铁离子,调节溶液PH的目的是使![]() 和
和![]() 形成沉淀.所以滤液2的成分是
形成沉淀.所以滤液2的成分是![]() ,滤渣2的成分为氢氧化铁和氢氧化铝。
,滤渣2的成分为氢氧化铁和氢氧化铝。
![]() 稀硫酸、浓硝酸混合酸后加热,Cu、Al、Fe发生反应生成
稀硫酸、浓硝酸混合酸后加热,Cu、Al、Fe发生反应生成![]() 、
、![]() 、
、![]() ;所以滤渣1的成分是Pt和Au,滤液1中的离子是
;所以滤渣1的成分是Pt和Au,滤液1中的离子是![]() 、
、![]() 、
、![]() ;第
;第![]() 步Cu与酸反应的离子方程式为:
步Cu与酸反应的离子方程式为:![]() 或
或![]() ,Au、Pt和酸不反应,所以是滤渣,故答案为:
,Au、Pt和酸不反应,所以是滤渣,故答案为:![]() 或
或![]() ;Au、Pt;
;Au、Pt;
![]() 第
第![]() 步加
步加![]() 的作用是将
的作用是将![]() 氧化为
氧化为![]() ,过氧化氢做氧化剂不引入杂质,对环境无污染,调节溶液PH铁离子和铝离子全部沉淀后过滤得到氢氧化铁、氢氧化铝沉淀和滤液硫酸铜, 故答案为:将
,过氧化氢做氧化剂不引入杂质,对环境无污染,调节溶液PH铁离子和铝离子全部沉淀后过滤得到氢氧化铁、氢氧化铝沉淀和滤液硫酸铜, 故答案为:将![]() 氧化为
氧化为![]() ;不引入杂质,对环境无污染;使
;不引入杂质,对环境无污染;使![]() 、
、![]() 沉淀除去;
沉淀除去;
![]() 第
第![]() 步由五水硫酸铜制备硫酸铜的方法应是在坩埚中加热脱水,经过蒸发、冷却、结晶、过滤,最终制得硫酸铜晶体;,故答案为:加热滤液2,经过蒸发、冷却、结晶、过滤,最终制得硫酸铜晶体;
步由五水硫酸铜制备硫酸铜的方法应是在坩埚中加热脱水,经过蒸发、冷却、结晶、过滤,最终制得硫酸铜晶体;,故答案为:加热滤液2,经过蒸发、冷却、结晶、过滤,最终制得硫酸铜晶体;
![]() 制备硫酸铝晶体的甲、乙、丙三种方法中, 甲方案在滤渣中只加硫酸会生成硫酸铁和硫酸铝,冷却、结晶、过滤得到的硫酸铝晶体中混有大量硫酸铁杂质,方法不可行;乙和丙方法均可行;乙方案先在滤渣中加
制备硫酸铝晶体的甲、乙、丙三种方法中, 甲方案在滤渣中只加硫酸会生成硫酸铁和硫酸铝,冷却、结晶、过滤得到的硫酸铝晶体中混有大量硫酸铁杂质,方法不可行;乙和丙方法均可行;乙方案先在滤渣中加![]() ,生成
,生成![]() 和
和![]() ,再加Al粉和
,再加Al粉和![]() 生成
生成![]() ,蒸发、冷却、结晶、过滤可得硫酸铝晶体; 丙方案先在滤渣中加NaOH和
,蒸发、冷却、结晶、过滤可得硫酸铝晶体; 丙方案先在滤渣中加NaOH和![]() 反应生成
反应生成![]() ,再在滤液中加
,再在滤液中加![]() 生成
生成![]() ,蒸发、冷却、结晶、过滤可得硫酸铝晶体;但从原子利用角度考虑方案乙更合理,因为丙加的NaOH和制备的
,蒸发、冷却、结晶、过滤可得硫酸铝晶体;但从原子利用角度考虑方案乙更合理,因为丙加的NaOH和制备的![]() 的原子组成没有关系,造成原子浪费,所以从原子利用率和是否产生杂质考虑知,乙更合理, 故答案为:甲;所得产品中含有较多
的原子组成没有关系,造成原子浪费,所以从原子利用率和是否产生杂质考虑知,乙更合理, 故答案为:甲;所得产品中含有较多![]() 杂质;乙;
杂质;乙;
![]() 取ag试样配成100mL溶液,每次取
取ag试样配成100mL溶液,每次取![]() ,消除干扰离子后,用
,消除干扰离子后,用![]() 标准溶液滴定至终点,平均消耗EDTA溶液
标准溶液滴定至终点,平均消耗EDTA溶液![]() 滴定反应如下:
滴定反应如下:![]() ,铜离子物质的量和标准液物质的量相同,则20mL溶液中铜离子的物质的量
,铜离子物质的量和标准液物质的量相同,则20mL溶液中铜离子的物质的量![]() ; 则ag样品中
; 则ag样品中![]() 的质量
的质量![]() ,所以
,所以![]() 质量分数的表达式
质量分数的表达式![]() ,故答案为:
,故答案为:![]() 。
。

 阅读快车系列答案
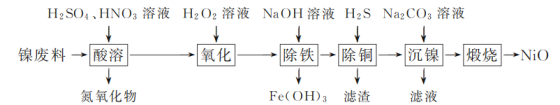
阅读快车系列答案【题目】以镍废料(主要成分为镍铁合金,含少量铜)为原料,生产NiO的部分工艺流程如下:
已知:下表列出了几种金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.7 |
沉淀完全的pH | 3.3 | 9.9 | 9.2 |
(1) “酸溶”时Ni转化为NiSO4,该过程中温度控制在70~80 ℃的原因是________。
(2) “氧化”时,Fe2+参加反应的离子方程式为________。
(3) “除铁”时需控制溶液的pH范围为________。
(4) “滤渣”的主要成分为________(填化学式)。
(5) “沉镍”时得到碱式碳酸镍[用xNiCO3·yNi(OH)2表示]沉淀。
①在隔绝空气条件下,“煅烧”碱式碳酸镍得到NiO,该反应的化学方程式为________。
②“沉镍”时,溶液pH增大,碱式碳酸镍中Ni元素含量会增加,原因是________。
【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向苯酚浊液中滴加Na2CO3溶液,浊液变清 | 苯酚的酸性强于H2CO3的酸性 |
B | 向碘水中加入等体积CCl4,振荡后静置,上层接近无色,下层显紫红色 | I2在CCl4中的溶解度大于在水中的溶解度 |
C | 向CuSO4溶液中加入铁粉,有红色固体析出 | Fe2+的氧化性强于Cu2+的氧化性 |
D | 向NaCl、NaI的混合稀溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成 | Ksp(AgCl) >Ksp(AgI) |
A. A B. B C. C D. D
【题目】磷石膏是磷氨厂生产硫酸和磷酸所排放的废渣![]() 主要成分为
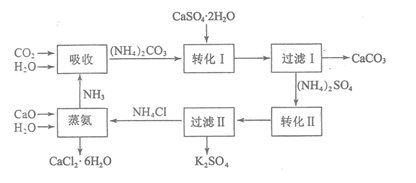
主要成分为![]() ,大量堆积既占用土地,又易造成环境污染和硫资源的浪费,所以可从资源综合利用的角度将磷石膏转化成硫酸钾和氯化钙晶体,工艺流程如下:
,大量堆积既占用土地,又易造成环境污染和硫资源的浪费,所以可从资源综合利用的角度将磷石膏转化成硫酸钾和氯化钙晶体,工艺流程如下:
请回答以下问题:
![]() 为了提高原料的利用率,吸收流程中通入
为了提高原料的利用率,吸收流程中通入![]() 和
和![]() 的先后顺序最好为______。
的先后顺序最好为______。
![]() 碳酸铵溶液与磷石膏悬浊溶液混合后发生转化I的离子反应方程式为______。
碳酸铵溶液与磷石膏悬浊溶液混合后发生转化I的离子反应方程式为______。
![]() 工艺流程中除了所给出的
工艺流程中除了所给出的![]() 、
、![]() 、
、![]() 、
、![]() 等原料外,在转化Ⅱ的过程中还需要加入______原料。
等原料外,在转化Ⅱ的过程中还需要加入______原料。
![]() 过滤Ⅱ后所得滤液
过滤Ⅱ后所得滤液![]() 溶液,确认其中含有
溶液,确认其中含有![]() 的方法是:______;
的方法是:______;
![]() 氯化钙结晶水合物
氯化钙结晶水合物![]() 是目前常用的无机储热材料,选择的依据是因为______
是目前常用的无机储热材料,选择的依据是因为______![]() 选填序号
选填序号![]() ;
;
A.熔点较低![]() 熔化
熔化![]()
![]() 能导电
能导电![]() 能制冷
能制冷![]() 无毒
无毒
![]() 已知不同温度下
已知不同温度下![]() 在100g水中达到饱和时溶解的量如下表:
在100g水中达到饱和时溶解的量如下表:
温度 | 0 | 20 | 60 |
|
|
|
|
![]() 时
时![]() 的饱和溶液
的饱和溶液![]() 冷却到
冷却到![]() ,可析出
,可析出![]() 晶体______g。
晶体______g。
![]() 上述工艺流程中循环利用的物质是______;还有一种物质,只要其纯净,也可以被循环利用,它是______
上述工艺流程中循环利用的物质是______;还有一种物质,只要其纯净,也可以被循环利用,它是______![]() 均填化学式
均填化学式![]() 。
。