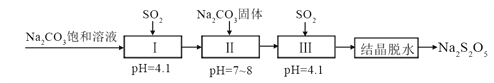
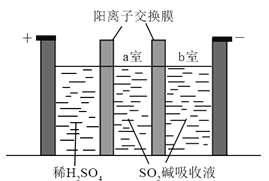
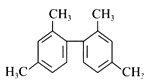
题目内容
【题目】把3molP和2.5molQ置于2L密闭容器中,发生如下反应:3P(g)+Q(g)![]()
![]() xM(g)+2N(g),5min后达到平衡,生成N1mol,经测定M的平均速率是0.1mol/(Lmin),下列叙述错误的是( )
xM(g)+2N(g),5min后达到平衡,生成N1mol,经测定M的平均速率是0.1mol/(Lmin),下列叙述错误的是( )
A. P的平均反应速率是0.15mol/(Lmin)
B. Q的转化率是25%
C. Q的平衡浓度是1mol/L
D. x的值为2
【答案】BD
【解析】
把3molP和2.5molQ置于2L密闭容器中,5min后达到平衡,生成1mol N,则:
3P(g)+Q(g)![]()
![]() xM(g)+2N(g)
xM(g)+2N(g)
起始量(mol):3 2.5 0 0
变化量(mol):1.5 0.5 0.25x 1
平衡量(mol):1.5 2 0.25x 1
A.v(P)= =0.15mol/(L.min),故A正确;
=0.15mol/(L.min),故A正确;
B.Q转化率=![]() ×100%=20%,故B错误;
×100%=20%,故B错误;
C.Q的平衡浓度为![]() =1mol/L,故C正确;
=1mol/L,故C正确;
D.根据M的速率,则0.25x=0.1mol/(L.min)×5min×2L,解得x=4,故D错误,
故选:BD.

 同步练习强化拓展系列答案
同步练习强化拓展系列答案【题目】亚硝酰氯(NOCl)是有机合成中的重要试剂。回答下列问题:
(1)NOCl虽然不稳定,但其原子均达到8e-稳定结构,NOCl的电子式为_________________。
(2)一定条件下,在密闭容器中发生反应:2NOCl(g)![]() 2NO(g)+Cl2(g),其正反应速率表达式为v正=k·cn( NOCl)(k为速率常数),测得v正和c(NOCl)的关系如表:
2NO(g)+Cl2(g),其正反应速率表达式为v正=k·cn( NOCl)(k为速率常数),测得v正和c(NOCl)的关系如表:
序号 | c(NOCl)/(mol·L-1) | v正/(mol·L-1·s-1) |
① | 0.30 | 3.60×10-9 |
② | 0.60 | 1.44×10-8 |
则n=_________;k=___________。
(3)25 ℃时,制备亚硝酰氯所涉及的热化学方程式和平衡常数如表:
序号 | 热化学方程式 | 平衡常数 |
① | 2NO2(g)+NaCl(s) | K1 |
② | 4NO2(g)+2NaCl(s) | K2 |
③ | 2NO(g)+Cl2(g) | K3 |
则该温度下,ΔH3=______kJ/mol;K3=______(用K1和K2表示)。
(4)25℃时,在体积为2L的恒容密闭容器中通入0.08 mol NO和0.04 molCl2发生上述反应③,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强(p)随时间(t)的变化如图曲线a所示,则ΔH3=______(填“>”“<”或“=”)0;若其他条件相同,仅改变某一条件,测得其压强(p)随时间(t)
的变化如图曲线b所示,则改变的条件是_____________;K3=___________L/mol;在5 min时,再充入0.08 mol NO和0.04 molCl2,则混合气体的平均相对分子质量将_____________(填“增大”、“减小”或“不变”)。

【题目】80 ℃时,将0.4 mol的四氧化二氮气体充入2 L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
时间/s c(mol·L-1) | 0 | 20 | 40 | 60 | 80 | 100 |
c(N2O4) | 0.20 | a | 0.10 | c | d | e |
c(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
反应进行至100 s后将反应混合物的温度降低,发现气体的颜色变浅。
(1)该反应的化学方程式为______________________________________________。
(2)表中b=______,c______d(填“<”“=”或“>”)。
(3)20 s时,N2O4的浓度为______mol·L-1,0~20 s内N2O4的平均反应速率为________。
(4)该反应的平衡常数表达式K=_____,在80 ℃时该反应的平衡常数K值为________。
(5)在其他条件相同时,该反应的K值越大,表明建立平衡时________。
A.N2O4的转化率越高 B.NO2的产量越大
C.N2O4与NO2的浓度之比越大 D.正反应进行的程度越大
E.所耗时间越少 F.容器内气体压强越大