题目内容
20.下列说法正确的是( )| A. | 100 mL 2.0 mol/L 的盐酸与100 mL 2.0 mol/L 的醋酸溶液中氢离子个数均为0.2×6.02×1023 | |
| B. | 每摩尔烷烃(CnH2n+2)含有的共价键数目为(3n+1)×6.02×1023 | |
| C. | 标准状况下,11.2 L四氯化碳所含分子数为0.5×6.02×1023 | |
| D. | 24g镁在足量CO2中燃烧转移的电子数目为4×6.02×1023 |
分析 A.醋酸为弱电解质,不能完全电离;
B.CnH2n+2总含有n-1个C-C键,含有n+2个C-H键;
C.标准状况下,四氯化碳为液体;
D.镁在足量CO2中燃烧生成MgO.
解答 解:A.醋酸为弱电解质,不能完全电离,100 mL 2.0 mol/L 的醋酸溶液中氢离子个数小于0.2×6.02×1023,故A错误;
B.CnH2n+2总含有n-1个C-C键,含有n+2个C-H键,则100 mL 2.0 mol/L 的醋酸溶液中氢离子个数均为0.2×6.02×1023,故B正确;
C.标准状况下,四氯化碳为液体,不能根据气体摩尔体积计算,故C错误;
D.镁在足量CO2中燃烧生成MgO,24g镁在足量CO2中燃烧转移的电子数目2mol,则电子数目为2×6.02×1023,故D错误.
故选B.
点评 本题考查较为综合,涉及电解质、共价键以及物质的量的计算,为高频考点,侧重于学生的分析、计算能力的考查,难度不大.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
15.用过量的H2SO4、NaOH、NH3•H2O、NaCl等溶液,按图所示步骤分开五种离子,则溶液①②③④是( )

| A. | ①NaCl ②NaOH ③NH3•H2O ④H2SO4 | B. | ①H2SO4 ②NaOH ③NH3•H2O ④NaCl | ||
| C. | ①NaCl ②NH3•H2O ③NaOH ④H2SO4 | D. | ①H2SO4 ②NH3•H2O ③NaOH ④NaCl |
5.下列实验方案不能达到相应实验预期目的是( )
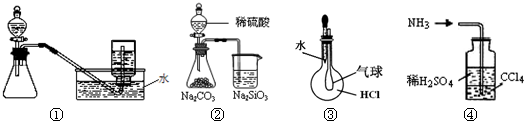

| A. | ①用铜和浓硝酸制取少量NO2 | B. | ②比较S、C、Si的非金属性 | ||
| C. | ③验证HCl溶解性 | D. | ④用于吸收NH3尾气,并防止倒吸 |
9.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 10mL 18mol/L浓硫酸与足量铜加热充分反应,其中有0.09NA个H2SO4体现了氧化性 | |
| B. | 33.6LCl2一定能与56g铁在加热条件下发生反应 | |
| C. | 12.0g熔融的NaHSO4中含有的阳离子数为0.2NA | |
| D. | 在反应14CuSO4+5FeS2+12H2O═7Cu2S+5FeSO4+12H2SO4中,5molFeS2发生反应,有21NA个电子发生转移 |
10.甲苯,己烯,氯仿,苯酚溶液,乙酸,乙醛可用( )一次性鉴别.
| A. | 溴水 | B. | 酸性高锰酸钾溶液 | ||
| C. | 氯化铁溶液 | D. | 新制氢氧化铜悬溶液 |
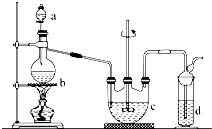 硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革还原剂.它易溶于水,不溶于醇,受热、遇酸易分解.工业上可用反应:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2制得.实验室模拟该工业过程的装置如图所示.
硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革还原剂.它易溶于水,不溶于醇,受热、遇酸易分解.工业上可用反应:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2制得.实验室模拟该工业过程的装置如图所示.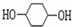 的路线如图所示.请按要求作答
的路线如图所示.请按要求作答
 .
. ,F
,F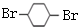 .
. ,
, .
.