��Ŀ����
����Ŀ����������ȡ���������ͼ����֪���з�����Ӧ�Ļ�ѧ����ʽΪ��Cl2+2KI=2KCl+I2���� �ش��������⣺

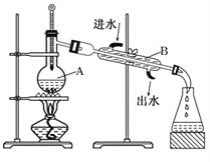
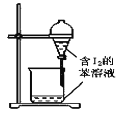
��1��ָ����ȡ��Ĺ������й�ʵ������ٺ͢۵����ƣ�________��________��
��2���� 3 mL ��ˮ�У����� 1 mL ���Ȼ�̼�������ú۲쵽�Թ���ķֲ���������ͼ�е�________ (ע���Թ�����ɫ��Ϊ�Ϻ�ɫ��Һ)��

��3�����һ�������Ƶþ�̬��ʱ��������������ƿ�е��л���ʵ���ɫ���Ʋ���ԭ����__________
�������� 480mL0.5mol��L��1 �� NaOH ��Һ���Իش��������⡣
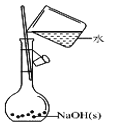
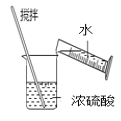
��4������������Һ��Ҫ�������У�ҩ�ס�������ƽ����Ͳ����������________��
��5��ijѧ��ʵ�����Ƶ� NaOH ��Һ��Ũ��Ϊ 0.51mol��L��1��ԭ�������_________��
A ʹ����ֽ���� NaOH ���� B ����ƿ��ԭ����������ˮ
C �ܽ����ձ�δ�����ϴ�� D �ý�ͷ�ιܼ�ˮ����ʱ���ӿ̶�
E ��ˮʱ�����̶��ߣ��ý�ͷ�ι����� F ת����Һ֮ǰδ����ȴ
���𰸡����� ��ȡ��Һ D �ⵥ�������� 500 mL������ƿ���ձ�����ͷ�ι� D F
��������
��1������ɹ�����պ�õ�����ң����ݺ���ˣ���ҺΪ����I-����Һ������Һ��ͨ��һ�����������������ɽ�I-����ΪI2���õ�����I2��ˮ��Һ������ȡ��Һ���ɵõ���I2���л���Һ�������ɵõ�����⣻
��2�����ˮ�м������Ȼ�̼����������ȡ����Һ�ֲ㣬���л����ܶȴ���ˮ�㣻
��3������ʱ���������еĵ���ɫ����ΪI2����������
��4�������� 480mL0.5mol��L��1 �� NaOH ��Һ����������ƽ����һ��������NaOH���壬���ձ����ܽ⣬��ȴ�����º��ز���������Һת����500ml������ƿ�У�������ˮϴ���ձ��Ͳ�����2-3�Σ�ϴ��ҺҲע������ƿ��������ƿ�м�ˮ����̶���1-2cm�������ý�ͷ�ιܵμ�ˮ��ֱ����Һ����͵���̶������У��ݴ˷������
��5��A.NaOH�׳��⣬������ֽ������������������ճ����ֽ�ϣ�ʹ���ʵ������٣�
B. ����ƿ��ԭ����������ˮ������Һ��Ũ����Ӱ�죻
C. �ܽ����ձ�δ�����ϴ�ӣ����ʵ������٣�
D. �ý�ͷ�ιܼ�ˮ����ʱ���ӿ̶ȣ�ʹ�����ˮ����ƫ�٣�
E. ��ˮʱ�����̶��ߣ��ý�ͷ�ι��������Ὣ����������������ʹ���ʵ������٣�
F. ת����Һ֮ǰδ����ȴ����ˮ���ݺ���Һ�����С��
��1���ɷ�����֪������Ϊ���ˣ�������Ϊ��ȡ��Һ��
��2�����ˮ�м������Ȼ�̼����������ȡ����Һ�ֲ㣬�γ�ˮ��͵�����Ȼ�̼��Һ�㣬�ҵ�����Ȼ�̼��Һ�ܶȴ���ˮ����ܶȣ���˵�����Ȼ�̼��Һ�����²㣬����Ҫ����Թ�ΪD��
��3����I2���������������ʱ���������е��л���ʵ���ɫ��
��4���ɷ�����֪�������� 480mL0.5mol��L��1 �� NaOH ��Һ����Ҫ������Ϊ��������ƽ���ձ�����������ҩ�ס���Ͳ��500ml����ƿ�ͽ�ͷ�ιܣ�
��5��A.NaOH�׳��⣬������ֽ������������������ճ����ֽ�ϣ�ʹ���ʵ������٣��������Ƶ���ҺŨ��ƫС��A�����
B. ����ƿ��ԭ����������ˮ������Һ��Ũ����Ӱ�죬B�����
C. �ܽ����ձ�δ�����ϴ�ӣ����ʵ������٣��������Ƶ���ҺŨ��ƫС��C�����
D. �ý�ͷ�ιܼ�ˮ����ʱ���ӿ̶ȣ�ʹ�����ˮ����ƫ�٣�����������ҺŨ��ƫ��D����ȷ��
E. ��ˮʱ�����̶��ߣ��ý�ͷ�ι��������Ὣ����������������ʹ���ʵ������٣��������Ƶ���ҺŨ��ƫС��E�����
F. ת����Һ֮ǰδ����ȴ����ˮ���ݺ���Һ�����С������������ҺŨ��ƫ��F����ȷ��
��ѡDF��

 ��У����ϵ�д�
��У����ϵ�д�