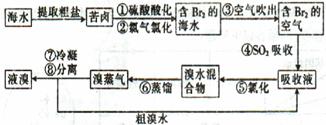
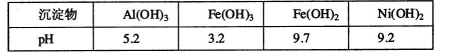
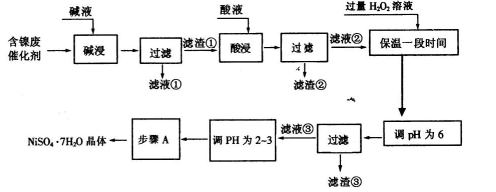
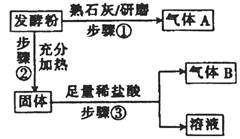
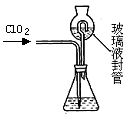
题目内容
用下列装置进行相应实验,能达到目的的是
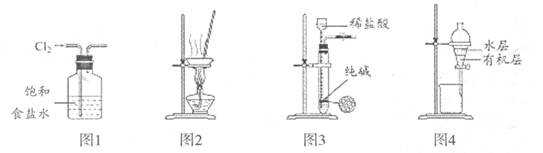

| A.用图1装置除去C12中少量的HCl |
| B.用图2装置蒸干NH4Cl饱和溶液制取NH4Cl晶体 |
| C.用图3装置制取纯净的CO2气体 |
| D.用图4装置分离CCl4萃取碘水后的有机层和水层 |
AD
试题分析:HCl的溶解度大于NaCl,易溶于饱和食盐水,Cl2的溶解度小于NaCl,难溶于饱和食盐水,故A正确;NH4Cl能水解生成一水合氨和氯化氢,且该反应是吸热反应,蒸干饱和NH4Cl溶液能使其彻底水解,变成氨气、氯化氢、水蒸气,故B错误;Na2CO3+2HCl=2NaCl+CO2↑+H2O,盐酸具有强挥发性,因此只用图3装置制取的气体中含有CO2、HCl、H2O,一定不纯,故C错误;CCl4不溶于水,密度比水大,一定分层,I2微溶于水,易溶于CCl4,CCl4可萃取碘水中的碘单质,下层为碘的CCl4层,上层为水层,故D正确。

练习册系列答案
相关题目