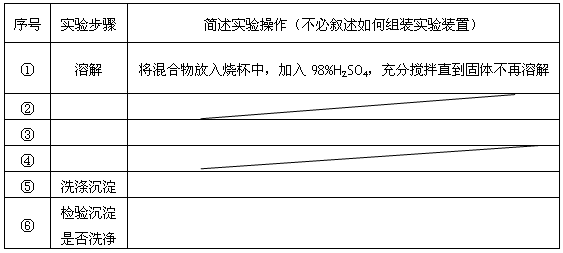
题目内容
除去下列物质中所含少量杂质(括号内),所选用的试剂和分离方法能达到实验目的的是
| | 混合物 | 试剂 | 分离方法 |
| A | 蔗糖(葡萄糖) | 银氨溶液 | 过滤 |
| B | 甲烷(乙烯) | 溴水 | 洗气 |
| C | 乙酸乙酯(乙酸) | 氢氧化钠溶液 | 蒸馏 |
| D | 淀粉胶体(氯化钠溶液) | 蒸馏水 | 分液 |
B
试题分析:A中的葡萄糖发生银镜反应生成葡萄糖酸铵,仍然溶解在蔗糖中,A不正确;乙烯含有碳碳双键,能和溴水发生加成反应,可以除去甲烷中的乙烯,B正确;C中乙酸乙酯和氢氧化钠也反应,应该用饱和碳酸钠溶液,C不正确;溶液可以透过半透膜,而胶体不能,所以要除去淀粉胶体中的氯化钠溶液,渗析即可,D不正确,答案选B。
点评:该题是基础性试题的考查,也是高考中的常见题型和重要的考点,有利于培养学生规范严谨的实验设计能力,有助于提升学生的学科素养。在解答物质分离提纯试题时,选择试剂和实验操作方法应遵循三个原则: 1.不能引入新的杂质(水除外),即分离提纯后的物质应是纯净物(或纯净的溶液),不能有其他物质混入其中;2.分离提纯后的物质状态不变;3.实验过程和操作方法简单易行,即选择分离提纯方法应遵循先物理后化学,先简单后复杂的原则。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目


 2Fe3O4+CO2
2Fe3O4+CO2