题目内容
6.已知反应:X+Y=M+N 为放热反应,对该反应的下列说法中正确的是( )| A. | X 的能量一定高于 M | |
| B. | X 和 Y 的总能量一定高于 M 和 N 的总能量 | |
| C. | Y 的能量一定高于 N | |
| D. | 因为该反应是放热反应,故不必加热反应就一定能发生 |
分析 反应X+Y=M+N为放热反应,则反应物的总能量比生成物的总能量高,以此来解答.
解答 解:A.反应物的总能量大于生成物的总能量,X的能量与M的能量关系无法确定,故A错误;
B.该反应为放热反应,所以反应物的总能量大于生成物的总能量,即X和Y的总能量一定高于M和N的总能量,故B正确;
C.反应物的总能量大于生成物的总能量,Y的能量不一定高于N,故C错误;
D.反应的放热、吸热与反应条件(如加热)无关,某些放热反应也需要加热才能反应,如氢气和氧气的反应,故D错误.
故选B.
点评 本题考查放热反应与反应物和生成物的总能量的关系,为高频考点,侧重于学生的分析能力的考查,注意信息中反应为放热反应来解答,难度不大.

练习册系列答案
 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
16.下列事实中,能说明CH4空间构型是正四面体的是( )
| A. | 难溶于水 | B. | CH2C12只有一种结构 | ||
| C. | 易燃气体 | D. | 不使高锰酸钾酸性溶液褪色 |
17.能说明醋酸是弱电解质的事实是( )
①用浓硫酸和醋酸钠固体共热可以制得醋酸,②醋酸钠水溶液呈碱性,
③可以用食醋清除水壶中的水垢,④pH=2的醋酸溶液稀释1000倍后的pH<5.
①用浓硫酸和醋酸钠固体共热可以制得醋酸,②醋酸钠水溶液呈碱性,
③可以用食醋清除水壶中的水垢,④pH=2的醋酸溶液稀释1000倍后的pH<5.
| A. | ①③④ | B. | ①② | C. | ②④ | D. | ② |
14.下列对分子及性质的解释中,不正确的是( )
| A. | 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释 | |
| B. | 由于乳酸(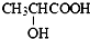 )中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体;生产中可利用“手性合成”法主要得到其中一种手性分子 )中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体;生产中可利用“手性合成”法主要得到其中一种手性分子 | |
| C. | 许多过渡金属离子对多种配体具有很强的结合力,因而,只有过渡金属才能形成配合物 | |
| D. | 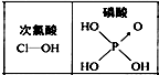 由如图可知酸性:H3PO4>HClO,因为H3PO4分子中有1个非羟基氧原子 |
1.乙酸乙酯和丙酸的混合物中氧元素质量分数为30%,则氢元素的质量分数为( )
| A. | 40% | B. | 30% | C. | 10% | D. | 20% |
11.要增大过量Zn 和一定量稀 H2SO4间反应生成氢气的速率,下列措施正确的是( )
| A. | 使用高纯度的锌粒 | B. | 滴加几滴硫酸铜溶液 | ||
| C. | 使用浓H2SO4 | D. | 使用浓HNO3 |
18.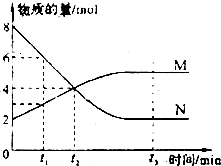 在一定温度下,容器内某反应中M、N的物质的量随反应时间变化的曲线如下图,下 列表述中正确的是( )
在一定温度下,容器内某反应中M、N的物质的量随反应时间变化的曲线如下图,下 列表述中正确的是( )
 在一定温度下,容器内某反应中M、N的物质的量随反应时间变化的曲线如下图,下 列表述中正确的是( )
在一定温度下,容器内某反应中M、N的物质的量随反应时间变化的曲线如下图,下 列表述中正确的是( )| A. | t3时,正反应速率大于逆反应速率 | |
| B. | t2时,正逆反应速率相等,反应达到平衡状态I 已反应的 | |
| C. | 化学方程式为:2M=N | |
| D. | t1时,N的浓度是M浓度的2倍 |
15.将足量的铜片与20mL 18mol•L-1浓硫酸加热充分反应,收集到标准状况下的二氧化硫气体VL.下列对此反应的有关说法中错误的是( )
| A. | 该反应体现了浓H2SO4的酸性和强氧化性 | |
| B. | 被还原的硫酸为$\frac{V}{22.4}$mol | |
| C. | 反应结束后两种反应物均有剩余 | |
| D. | 参加反应的铜为0.18mol |
16.下列有关原子结构和元素周期律叙述中不正确的是( )
| A. | 第IA族碱金属元素最高价氧化物的水化物的碱性随原子序数递增而增强 | |
| B. | 第ⅦA族元素是同周期中非金属性最强的元素 | |
| C. | 第ⅦA元素从上到下,其氢化物的稳定性逐渐减弱 | |
| D. | 同周期元素(除0族元素外)从左到右,原子半径和离子半径都逐渐减小 |