题目内容
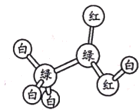
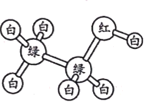
【题目】a、b、c、d、e为原子序数依次增大的五种常见短周期元素,可组成一种化合物A,其化学式为ba4d(ec4)2。A能够发生如下转化关系:

己知C的分子式为ba3,能使湿润的红色石蕊试纸变蓝。则下列说法正确的是
A.原子半径b>c
B.e的氧化物的水化物为强酸
C.化合物A为共价化合物
D.元素非金属性强弱c<e
【答案】A
【解析】
A和氢氧化钠溶液反应生成B和C,C为气体,C的分子式为ba3,能使湿润的红色石蕊试纸变蓝,根据化学式可推断C为氨气,B为白色沉淀,继续加入氢氧化钠溶液沉淀溶解,则B可推断为氢氧化铝,A中加入酸化的氯化钡溶液形成白色沉淀,则A中含有硫酸根离子,根据以上推断,A为NH4Al(SO4)2,a为H元素,b为N元素,c为O元素,d为Al元素,e为S元素,据此分析解答。
A.b为N元素,c为O元素,同周期元素随核电荷数增大,半径逐渐减小,则原子半径b>c,故A正确;
B.e为S元素,S的氧化物的水化物有硫酸和亚硫酸,亚硫酸是弱酸,故B错误;
C.A为NH4Al(SO4)2,是离子化合物,故C错误;
D.c为O元素,e为S元素,同主族元素随核电荷数增大非金属性逐渐减弱,元素非金属性强弱c>e,故D错误;
答案选A。

 小夫子全能检测系列答案
小夫子全能检测系列答案【题目】N2O5在一定温度下可发生反应:2N2O5(g)![]() 4NO2(g)+O2(g) ΔH>0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表:
4NO2(g)+O2(g) ΔH>0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表:
时间/s | 0 | 500 | 1000 | 1500 |
c(N2O5)/(mol·L-1) | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法正确的是( )
A.500s内NO2的生成速率为2.96×10-3mol/(L·s)
B.T1温度下该反应平衡时N2O5的转化率为29.6%
C.平衡后,其他条件不变,将容器体积变为原来的![]() ,则c(N2O5)<5.00mol/L
,则c(N2O5)<5.00mol/L
D.T1、T2温度下的平衡常数分别为K1、K2,若T1>T2,则K1>K2