题目内容
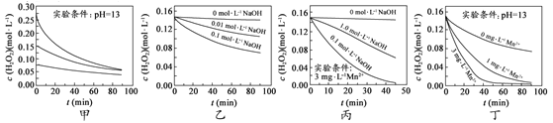
【题目】25℃,向20 mL 0.1 mol·L-1 H2A溶液中滴加0.1 mol·L-1的NaOH溶液,有关粒子物质的量的变化如图所示。下列说法正确的是

A.II表示微粒A2-的物质的量的变化曲线
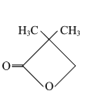
B.H2A在水中的第一步电离方程式为H2A![]() A2-+2H+
A2-+2H+
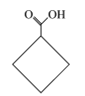
C.![]() 的值随着V[NaOH(aq)]的增大而减小
的值随着V[NaOH(aq)]的增大而减小
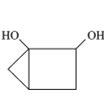
D.V[NaOH(aq)]=20 mL时,溶液中存在关系:c(HA-)+c(A2-)+c(H2A)=0.1 mol/L
【答案】C
【解析】
A.H2A总物质的量为2×10-3 mol,结合图象可知,氢氧化钠溶液体积为0时,0.1 mol/LH2A溶液中H2A的物质的量为1.5×10-3 mol,说明H2A在溶液中不能电离,所以H2A为弱酸,存在电离平衡:H2A![]() H++HA-,HA-
H++HA-,HA-![]() H++A2-,电离程度是微弱的,主要以H2A存在,第一步电离产生的H+对第二步电离起抑制作用,故I表示H2A,II表示HA-,III表示A2-的浓度变化曲线,A错误;
H++A2-,电离程度是微弱的,主要以H2A存在,第一步电离产生的H+对第二步电离起抑制作用,故I表示H2A,II表示HA-,III表示A2-的浓度变化曲线,A错误;
B.H2A是二元弱酸,电离分步进行,第一步电离方程式为H2A![]() H++HA-,B错误;
H++HA-,B错误;
C. 由电离平衡常数可知: ,温度不变,K1不变,随着NaOH溶液的加入c(H+)逐渐进行,所以
,温度不变,K1不变,随着NaOH溶液的加入c(H+)逐渐进行,所以![]() 会随着V[NaOH(aq)]的增大而减小,即
会随着V[NaOH(aq)]的增大而减小,即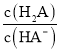 会逐渐减小,C正确;
会逐渐减小,C正确;
D.V[NaOH(aq)]=20 mL时,发生反应:NaOH+H2A=NaHA+H2O,溶质为NaHA,根据物料守恒可得:c(HA-)+c(A2-)+c(H2A)=c(Na+)=![]() =0.05 mol/L,D错误;
=0.05 mol/L,D错误;
故合理选项是C。

【题目】工业上利用电镀污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶性杂质)回收铜和铬等金属,回收流程如图所示:

已知部分物质沉淀的pH(如表)及CaSO4元的溶解度曲线(如图):
Fe3+ | Cu2+ | Cr3+ | |
开始沉淀 | 2.1 | 4.7 | 4.3 |
完全沉淀 | 3.2 | 6.7 | 5.6 |

(1)在浸出过程中除了生成Fe2(SO4)3、Cr2(SO4)3外,主要还有_____________(填化学式)。
(2)在除铁操作中,需要除去Fe3+和CaSO4,请完成相关操作:①加入石灰乳调节pH到______;
②将浊液加热到80℃,____________。
(3)写出还原步骤中加入NaHSO3生成Cu2O固体的离子方程式:_________,此步骤中加入NaHSO3得到Cu2O的产率为95%,若NaHSO3过量,除了浪费试剂外,还会出现的问题是______________。