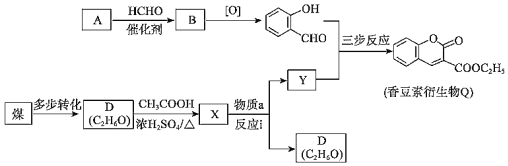
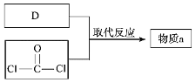
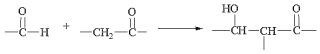题目内容
【题目】下列关于热化学反应的描述中正确的是
A.HCl和NaOH反应的中和热△//=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△=2×(-57.3)kJ/mol
B.需要加热才能发生的反应一定是吸热反应
C.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的△H=+2×283.0kJ/mo1
D.1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
【答案】C
【解析】
A.中和热是指生成1mol水放出的热量,H2SO4和Ca(OH)2反应生成硫酸钙和水,硫酸钙是微溶物,生成硫酸钙也要放热,A错误;
B.需要加热才能发生的反应不一定是吸热反应,有些放热反应也需要加热,例如:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,B错误;
2NH3(g) ΔH<0,B错误;
C.燃烧热是1mol纯净物完全燃烧生成稳定的氧化物放出的热量,则2CO2(g)=2CO(g)+O2 (g)反应的△H=+2×283.0kJ/mol,C正确;
D.燃烧热是1mol纯净物完全燃烧生成稳定的氧化物放出的热量,故1 mol甲烷燃烧生成液态水和二氧化碳所放出的热量是甲烷的燃烧热,D错误;
答案选C。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案【题目】取体积均为1 L的四组X的溶液进行实验(X受热发生分解反应),在不同温度下测得X的物质的量(mol)随时间的变化如下表所示。下列说法不正确的是
| 0 min | 10 min | 20 min | 30 min | 40 min | 50 min | 60 min | |
① | 10°C | 1.1 | 0.90 | 0.80 | 0.73 | 0.68 | 0.65 | 0.65 |
② | 10°C | a | 0.70 | 0.65 | 0.65 | 0.65 | 0.65 | 0.65 |
③ | 25°C | 1.0 | 0.70 | 0.50 | 0.35 | 0.25 | 0.20 | 0.20 |
④ | 30°C | 2.0 | 1.4 | 0.90 | 0.50 | 0.20 | 0.13 | 0.13 |
A.在0~10 min内,实验③④中X的转化率相同
B.实验②中改变的条件可能是加入催化剂
C.在10~20 min内,实验①中X的平均分解速率为0.01 mol L-1min-1
D.对比实验①和④,能说明X的反应速率随温度升高而增大
【题目】决定物质性质的重要因素是物质结构。请回答下列问题:
(1)已知元素M是组成物质Ca5(PO4)3F的一种元素。元素M的气态原子逐个失去第1个至第5个电子所需能量(即电离能,用符号I1至I5表示)如表所示:
电离能 | I1 | I2 | I3 | I4 | I5 |
电离能/(kJ·mol-1) | 589.8 | 1145.4 | 4912.4 | 6491 | 8153 |
元素M化合态常见化合价是________价,其基态原子电子排布式为________________。
(2)Ca3(PO4)3F中非金属元素电负性由大到小的顺序为________________。
(3)PO43-的中心原子的杂化方式为________,该离子的空间构型为________,键角为________,其等电子体有________(请写出两种)。
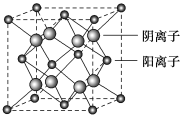
(4)已知MgO与CaO的晶体结构相似,其摩氏硬度的大小关系为________,原因为__________________。
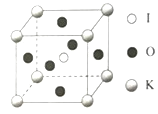
(5)CaF2晶胞结构如图所示,则CaF2晶体中与Ca2+最近且等距离的Ca2+数目为________;已知Ca2+和F-半径分别为a cm、b cm,阿伏加德罗常数为NA,M为摩尔质量,则晶体密度为________ g·cm-3(不必化简)。