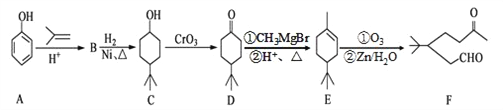
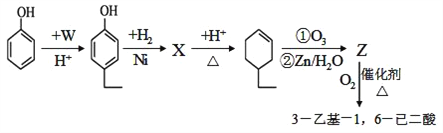
题目内容
【题目】电解质溶液电导率越大导电能力越强.常温下用0.100mol·L-1盐酸分别滴定10.00mL浓度均为0.100mol·L-1的NaOH溶液和二甲胺[(CH3)2NH]溶液(二甲胺在水中电离与氮相似,常温Kb[(CH3)2NH]=1.6×10-4。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是
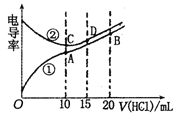
A. 曲线②代表滴定二甲胺溶液的曲线
B. A点溶液中:c(H+)=c(OH-)+c[(CH3)2NH·H2O]
C. D点溶液中:2c(Na+)=3c(Cl-)
D. 在相同温度下,A、B、C、D四点的溶液中,水的电离程度最大的是C点
【答案】B
【解析】A.等浓度的NaOH和二甲胺[(CH3)2NH]溶液,NaOH溶液的导电能力强,则曲线①为(CH3)2NHH2O的变化曲线,故A错误;B.A点溶液中,存在质子守恒,即:c(H+)=c(OH-)+c[(CH3)2NHH2O],故B正确;C.定量分析可知,D点溶液中,1.5c(Na+)=c(Cl-),即3c(Na+)=2c(Cl-),故C错误;D.酸或碱抑制水电离,含有弱离子的盐促进水电离,C点溶质为NaCl对水的电离无影响;A点溶质为(CH3)2NH2+·Cl-,促进水电离;B点为等物质的量浓度的(CH3)2NH2+·Cl-和HCl,HCl会抑制水的电离;D点为NaCl和HCl,HCl会抑制水的电离,所以在相同温度下,水的电离程度最大的点为A点,故D错误;故选B。

 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案【题目】《石雅》云:“青金石色相如天,或复金屑散乱,光辉灿烂,若众星丽于天也。”天为上,所以中国古代通常称青金石为帝王石,明淸尤重。青金石是指碱性铝硅酸盐矿物,其中含钠、铝、硅、硫、氯、氧等元素。
(1)铝元素基态原子的外围电子轨道表示式为_____________,基态硅原子核外电子占有的原子轨道数为_____________个,氧、硫、氯的第一电离能由大到小顺序为________________。
(2)SCl2分子中的中心原子杂化轨道类型是_____________,该分子空间构型为__________。
(3)第四周期中,与氯原子未成对电子数相同的金属元素有_______种。
(4)晶体硅的结构与金刚石非常相似。金刚石、晶体硅和金刚砂(碳化硅)的熔点由高到低的顺序为____________(填化学式)。
(5)下表是一组物质的沸点数据:
有机物 | 甲醇(CH3OH) | 丙烯(CH3CH=CH2) | 一氟甲烷(CH3F) |
相对分子质量 | 32 | 42 | 34 |
沸点/℃ | 64.7 | -47.7 | -78.2 |
若只考虑相对分子质量,甲醇沸点应低于-78.2℃,甲醇沸点高的原因是________。
丙烯中含有的α键与π键个数之比为______________。
(6)铝单质为面心立方晶体,其晶胞结构如图,晶胞参数qcm,铝的摩尔质量为Mg·mol-1,原子半径为r pm,阿伏伽德罗常数的值为NA,该晶体的空间利用率为_______________(只要求列算式,不必计算出数值)。