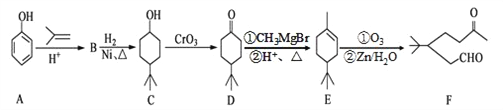
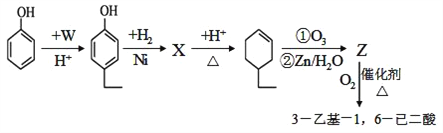
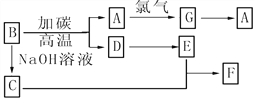
题目内容
【题目】下列关于如图所示电化学装置的分析正确的是( )
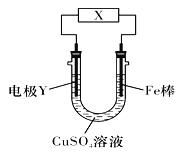
A. 若X为直流电源,Y为碳棒接负极,则Fe棒被保护
B. 若X为电流计,Y为锌棒,则SO42-移向Fe棒
C. 若X为导线,Y为铜棒,则Fe棒发生还原反应
D. 若X为直流电源,Y为铜棒接正极,则Fe棒上有铜析出
【答案】D
【解析】A、若X为直流电源,Y为碳棒接负极,则Fe棒接电源的正极,作阳极,首先被氧化,因此不能起到被保护的作用,选项A错误;B、若X为电流计,Y为锌棒,则构成了原电池,Zn为负极,发生氧化反应,根据同种电荷相互排斥,异种电荷相互吸引的原则,SO42-移向正电荷较多的Zn棒,选项B错误;C、若X为导线,Y为铜棒,则构成原电池,活动性强的Fe棒为负极,发生氧化反应,选项C错误;D、若X为直流电源,Y为铜棒接正极,阳极Cu是活性电极,发生氧化反应,变为Cu2+进入溶液,在阴极铁棒上溶液中的Cu2+得到电子,变为Cu单质附着,因此可以实现Fe棒上镀铜,选项D正确。答案选D。

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目