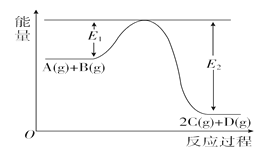
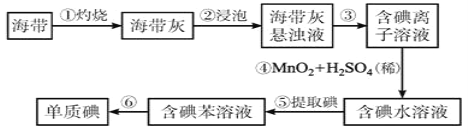
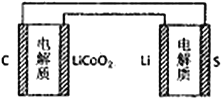
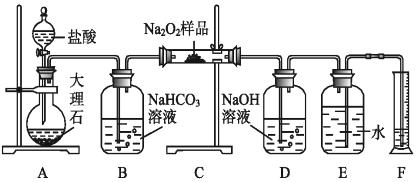
题目内容
【题目】反应3NO2+H2O=2HNO3+NO中,被氧化的物质与被还原的物质的物质的量之比为
A.1∶1B.1∶2C.2∶1D.3∶1
【答案】C
【解析】
NO2与水反应产生3NO2+H2O═2HNO3+NO,反应中只有氮元素的化合价发生变化,由+4价升高为+5价,由+4价降低为+2价,所以NO2既是氧化剂也是还原剂,氧化剂被还原的产物为还原产物,还原剂被氧化的产物为氧化产物,由产物中氮元素的化合价,可知起氧化剂与还原剂的NO2物质的量之比为1:2,还原剂被氧化,氧化剂被还原,所以被氧化的NO2与被还原的NO2的物质的量之比为2:1,答案选C。

练习册系列答案
 特高级教师点拨系列答案
特高级教师点拨系列答案
相关题目