题目内容
【题目】海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:请填写下列空白:
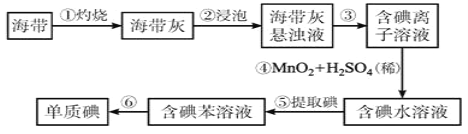
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是______________(从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是_______;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是______________。
(3)步骤④反应的离子方程式是_______________________________________________。
(4)步骤⑤中,某学生选择用苯来提取碘的理由___________________________________。
【答案】BDE 过滤 蒸馏2I-+MnO2+4 H+====Mn2++I2+2H2O苯与水互不相溶;碘在苯中的溶解度比在水中大
【解析】
实验室从海带中提取碘:海带灼烧成灰①,浸泡溶解得到海带灰悬浊液②,通过过滤③,得到不溶的残渣,滤液为含碘离子的溶液,加入酸和氧化剂MnO2④,将碘离子氧化成碘单质,利用有机溶剂苯萃取出碘单质⑤,再通过蒸馏提取出碘单质⑥。据此解答。
根据流程可知海带灼烧成灰,浸泡溶解得到海带灰悬浊液,通过过滤,得到不溶的残渣,滤液为含碘离子的溶液,加入氧化剂,将碘离子氧化成碘单质,利用有机溶剂萃取出碘单质,再通过蒸馏提取出碘单质。则
(1)灼烧固体物质一般使用(瓷)坩埚,而坩埚加热需要用泥三脚支撑然后放在三脚架上,三脚架下面放酒精灯,故答案为BDE;
(2)步骤③是分离固体和液体,则实验操作为过滤,步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,是利用互溶的两种液体的沸点不同来分离,则实验操作为蒸馏;
(3)步骤④是碘离子在酸性条件下被MnO2氧化生成单质碘,反应的离子方程式为2I-+MnO2+4H+=Mn2++I2+2H2O;
(4)根据萃取的基本原则两种溶剂互不相溶,且溶质在一种溶剂中的溶解度比在另一种大的多,因此步骤⑤中选择用苯来提取碘的理由是:苯与水互不相溶,碘在苯中的溶解度比在水中大。

 互动英语系列答案
互动英语系列答案【题目】CoCl26H2O是一种饲料营养强化剂。可由水钴矿[主要成分为Co2O3、Co(OH)3,还含有少量Fe2O3、Al2O3、MnO等]制取,其工艺流程如下:
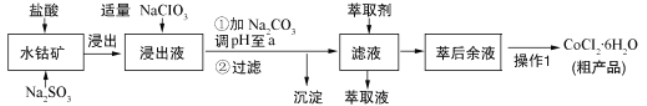
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等.
②流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表.
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③CoCl26H2O熔点为86℃,加热至110﹣120℃时,失去结晶水生成CoCl2.
回答下列问题:
(1)浸出水钴矿过程中,Fe2O3发生反应的化学方程式为________________________。
(2)向浸出液中加入适量NaClO3目的是______________________________________。
(3)“加Na2CO3调pH至a”,a=______;过滤所得沉淀的主要成分为_________(填化学式)。
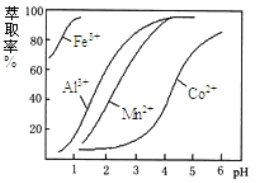
(4)萃取剂对金属离子的萃取与溶液pH的关系如下图所示,向“滤液”中加入该萃取剂的目的是__________,使用该萃取剂的最佳pH范围是_____(填选项字母)
A. 5.0﹣5.5 B. 4.0﹣4.5 C. 3.0﹣3.5 D. 2.0﹣2.5
(5)实验操作“操作1”为_______________、_________、过滤和减压烘干;制得的CoCl26H2O在烘干时需减压烘干的原因是________________________。