题目内容
2.用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行中和反应,通过测定反应过程中所放出的热量(盐酸和氢氧化钠溶液的密度为1g/cm3,反应前后温度差为3.4℃,反应前后的比热容按4.18J•g-1•℃-1),则中和热为( )| A. | -14.2 KJ/mol | B. | -28.4 KJ/mol | C. | -42.6 KJ/mol | D. | -56.8 KJ/mol |
分析 先根据Q=cm△T计算出反应放出的热量,再计算出生成1mol水放出的热量,就可以得到中和热.
解答 解:用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液的质量和为m=100mL×1g/cm3=100g,c=4.18J/(g•℃),温度差为3.4℃,代入公式Q=cm△T得生成0.025mol的水放出热量Q=4.18J/(g•℃)×100g×3.4℃=1.4212kJ,即生成0.025mol的水放出热量为1.4212kJ,所以生成1mol的水放出热量为1.4212kJ×$\frac{1mol}{0.025mol}$=-56.8 KJ/mol,即该实验测得的中和热△H=-56.8 KJ/mol,故选D.
点评 本题主要考查反应热的计算,题目难度大,注意理解中和热的概念.

练习册系列答案
相关题目
17.向1L下列溶液中加入0.5mol NaOH固体,溶液的导电能力基本没有变化的是( )
| A. | 0.5 mol•L-1盐酸 | B. | 0.5 mol•L-1 KOH溶液 | ||
| C. | 0.5 mol•L-1醋酸 | D. | 0.5 mol•L-1Na2SO4 |
14.设NA代表阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 1L 1mol•L-1的CH3COOH溶液中含有NA个氢离子 | |
| B. | 物质的量浓度为0.5 mol•L-1的MgCl2溶液中,含有Cl-个数为NA | |
| C. | 5.6 g铁与足量盐酸反应转移的电子数为0.3NA | |
| D. | 1g O2和1g O3中所含有的电子数均为0.5NA |
20.某化肥厂用H2O、CO2、NH3、CaSO4、制备(NH4)2SO4,工艺流程如下:
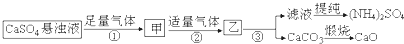
下列推断中正确的是( )

下列推断中正确的是( )
| A. | 步骤①和②中的气体属于可循环使用的气体 | |
| B. | 步骤②中发生的反应为:Ca2++CO2+2NH3•H2O═CaCO3↓+2NH4++H2O | |
| C. | 往甲中通CO2有利于(NH4)2SO4生成 | |
| D. | 以上涉及的化学反应中有氧化还原反应 |
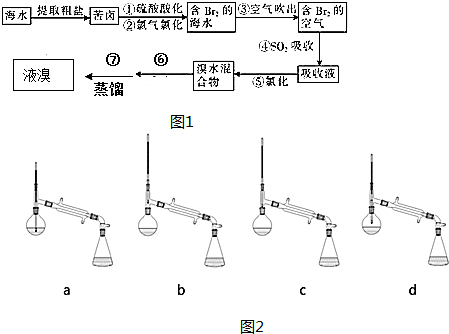
 ,在该反应中,当有0.1mol电子发生转移时,生成标准状况氯气的体积为1.12L.
,在该反应中,当有0.1mol电子发生转移时,生成标准状况氯气的体积为1.12L.