题目内容
下列说法正确的是( )
| A.反应热就是反应中放出的能量 |
| B.在101 kPa时,1 mol碳燃烧所放出的热量为碳的燃烧热 |
| C.等量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多 |
| D.由C(石墨)→C(金刚石) ΔH=+1.9 kJ·mol-1可知,金刚石比石墨稳定 |
C
解析试题分析:A.反应热,是等温下化学反应释放或吸收的热量。A错误;B.燃烧热是在25℃,101 kPa时,1 mol纯物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热.单位为kJ·mol-1,在101 kPa时,1 mol碳燃烧生成CO2所放出的热量为碳的燃烧热,B错误;C.硫固体气化时要吸热,C正确;D.金刚石所具有的能量高,比石墨稳定性低,D错误。选C。
考点:反应热

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
.强酸与强碱的稀溶液发生中和反应的热效应为:H+(aq) +OH-(aq)═H2O(l)
△H = -57.3kJ/mol。分别向1L 0.5mol/L的Ba(OH)2的溶液中加入①浓硫酸;② 稀硫酸;③稀硝酸,恰好完全反应的热效应分别为△H1、△H2、△H3,下列关系正确的是
| A.△H1<△H2=△H3 | B.△H1>△H2>△H3 |
| C.△H1>△H2=△H3 | D.△H1=△H2<△H3 |
下列关于化学反应与能量的说法正确的是( )
| A.化学反应中一定有物质变化但不一定有能量变化 |
B.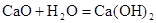 是放热反应,说明CaO的能量大于 是放热反应,说明CaO的能量大于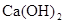 的能量 的能量 |
C.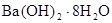 晶体与氯化铵晶体反应不需要加热就能发生,说明该反应是放热反应 晶体与氯化铵晶体反应不需要加热就能发生,说明该反应是放热反应 |
| D.由H2→2H的过程需要吸收能量 |
下列反应属于吸热反应的是
| A.葡萄糖在人体内氧化分解 | B.氢气在氧气中燃烧 |
| C.氢氧化钡晶体与氯化铵晶体反应 | D.氢氧化钾和硫酸中和 |
下列说法或表示方法正确的是
| A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |
| B.由C(石墨)=C(金刚石)△H="+1.90" kJ·mol-1可知,金刚石比石墨稳定 |
| C.在稀溶液中,H+(aq))+OH-(aq))=H2O(l)△H=-57.3 kJ·mol-1,若将含0.5 molH2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热大于57.3 kJ |
| D.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2 H2(g)+O2(g)="2" H2O(1)△H=-285.8 kJ·mol-1 |
已知反应 ①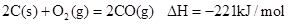
②稀溶液中,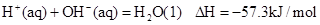 ,下列结论正确的是
,下列结论正确的是
| A.碳的燃烧热为110.5kJ/mol |
| B.2molC(s)+1molO2(g)的能量比2molCO(g)的能量高221kJ |
| C.0.5 molH2SO4(浓)与1 molNaOH溶液混合,产生57.3kJ热量 |
| D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3kJ热量 |
下列关于热化学反应的描述中正确的是
| A.HCl和NaOH反应的中和热ΔH=-57.3 kJ/mol,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3) kJ/mol |
| B.CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g) =2CO(g)+O2(g)反应的ΔH=+566.0 kJ/mol |
| C.需要加热才能发生的反应一定是吸热反应 |
| D.Ba(OH)2·8H2O与NH4Cl反应的焓变小于0,所以在常温下能自发进行 |
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的一种反应原理如下:
CH3OH(g) + H2O(g) → CO2(g) + 3H2(g) – 49.0 kJ
下列说法正确的是
| A.1 LCH3OH蒸汽与1 L水蒸汽反应生成1 L CO2气体与3 L氢气吸收热量49.0 kJ |
| B.1个CH3OH分子与1个水分子反应生成1个CO2分子与3个H2分子吸收49.0 kJ热量 |
| C.相同条件下1molCH3OH(g)与1mol H2O(g)的能量总和小于1molCO2(g)与3 mol H2(g)的能量总和 |
| D.1 molCH3OH蒸汽与1 mol液态水反应生成1mol CO2气体与3 mol 氢气吸收的热量小于49.0 kJ |
反应A(g)+B(g) C(g) +D(g)过程中的能量变化如图所示,下列说法正确的是
C(g) +D(g)过程中的能量变化如图所示,下列说法正确的是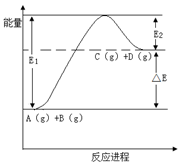
| A.该反应是放热反应 |
| B.加入催化剂后,反应加快,△E减小 |
| C.反应物的总键能大于生成物的总键能 |
| D.反应达到平衡时,升高温度,A的转化率增大 |