题目内容
反应A(g)+B(g) C(g) +D(g)过程中的能量变化如图所示,下列说法正确的是
C(g) +D(g)过程中的能量变化如图所示,下列说法正确的是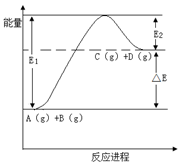
| A.该反应是放热反应 |
| B.加入催化剂后,反应加快,△E减小 |
| C.反应物的总键能大于生成物的总键能 |
| D.反应达到平衡时,升高温度,A的转化率增大 |
CD
解析试题分析:由于图中反应物的总能量低于生成物的总能量,则正反应是吸热反应,焓变大于0,故A选项错误;催化剂能够降低反应的活化能,使E1、E2均明显降低,因此能加快反应速率,但是对焓变没有影响,故B选项错误;图中反应物的总能量低于生成物的总能量,由于物质所含能量越底越稳定,则反应物比生成物稳定,从微观角度看,物质所含化学键的键能越大越稳定,则反应物的总键能大于生成物的总键能,故C选项正确;由于正反应是吸热反应,升高温度平衡向正反应方向移动,A的平衡转化率增大,故D选项正确。
考点:考查考生化学反应过程中体系能量变化的了解;考查考生对放热反应和吸热反应的了解;考查考生对物质稳定性与键能关系的了解;考查温度对平衡移动的影响的了解。

下列说法正确的是( )
| A.反应热就是反应中放出的能量 |
| B.在101 kPa时,1 mol碳燃烧所放出的热量为碳的燃烧热 |
| C.等量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多 |
| D.由C(石墨)→C(金刚石) ΔH=+1.9 kJ·mol-1可知,金刚石比石墨稳定 |
灰锡(以粉末状态存在)和白锡是锡的两种同素异形体。已知:
① Sn(s、白) + 2HCl(aq) → SnCl2(aq) + H2(g) + Q1
② Sn(s、灰) + 2HCl(aq) → SnCl2(aq) + H2(g) + Q2
 ③ Sn(s、灰)
③ Sn(s、灰)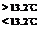 Sn(s、白) + Q3, Q3=" -" 2.1kJ
Sn(s、白) + Q3, Q3=" -" 2.1kJ
根据以上信息推断正确的是
| A.灰锡、白锡的互相转化是可逆反应 | B.常温下锡以灰锡状态存在 |
| C.反应中的能量变化:Q1 < Q2 | D.长期处于13.2℃以下,锡制器皿会自行毁坏 |
反应A+B→C分两步进行:①A+B→X,②X→C,反应过程中能量变化如下图所示,E1表示反应A+B→X的活化能。 下列有关叙述正确的是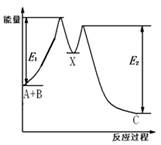
| A.E2表示反应X→C的活化能 |
| B.反应A+B→C的△H<0 |
| C.X是反应A+B→C的催化剂 |
| D.加入催化剂可改变反应A+B→C的焓变 |
下列有关能量的判断或表示方法正确的是
| A.从C(石墨)=C(金刚石)ΔH=1.9 kJ·mol-1,可知金刚石比石墨更稳定 |
| B.等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多 |
| C.由H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,则向含0.1 mol HCl的盐酸中加入4.0 gNaOH固体,放出热量等于5.73 kJ |
| D.2 gH2完全燃烧生成液态水放出285.8 kJ热量,则氢气燃烧的热化学方程式为: |
化学家认为石油、煤作为能源使用时,燃烧了“未来的原始材料”。下列对上述观点理解正确的是
| A.大力提倡使用廉价化石燃料作为能源 |
| B.应更多地利用石油和煤生产基本化工原料 |
| C.化石燃料属于可再生能源,不影响可持续发展 |
| D.研发新型催化剂,提高石油和煤中各组分的燃烧热 |
已知反应A+B= C+D的能量变化如下图所示,下列说法正确的是
| A.该反应是放热反应 |
| B.只有在加热条件下才能进行 |
| C.反应物的总能量高于生成物的总能量 |
| D.反应中断开化学键吸收的总能量高于形成化学键放出的总能量 |
下列关于判断过程的方向的说法正确的是( )
| A.所有自发进行的化学反应都是放热反应 |
| B.高温高压下可以使石墨转化为金刚石是自发的化学反应 |
| C.由能量判据和熵判据组合而成的复合判据,将更适合于所有的过程 |
| D.同一物质的固、液、气三种状态的熵值相同 |
(14分)工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
①CO(g)+H2O(g)  CO2(g)+H2(g) △H=-41 kJ/mol
CO2(g)+H2(g) △H=-41 kJ/mol
某小组研究在相同温度下该反应过程中的能量变化。他们分别在体积均为V L的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应。相关数据如下:
| 容器编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达平衡时体系能量的变化/kJ | ||||
| CO | H2O | CO2 | H2 | ||||
| ① | 1 | 4 | 0 | 0 | t1 | 放出热量:32.8 kJ | |
| ② | 2 | 8 | 0 | 0 | t2 | 放出热量:Q | |
(2)容器①中反应达平衡时,CO的转化率为 %。
(3)计算容器②中反应的平衡常数K= 。
(4)下列叙述正确的是 (填字母序号)。
A.平衡时,两容器中H2的体积分数相等
B.容器②中反应达平衡状态时,Q > 65.6 kJ
C.反应开始时,两容器中反应的化学反应速率相等
D.容器①中,化学反应速率为:

(5)已知:②2H2 (g) + O2 (g) = 2H2O (g) ΔH=-484 kJ/mol,写出CO完全燃烧生成CO2的热化学方程式: 。
(6)容器①中反应进行到t min时,测得混合气体中CO2的物质的量为0.6 mol。若用200 mL 5 mol/L的NaOH溶液将其完全吸收,反应的离子方程式为(用一个离子方程式表示) 。
(7)研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用图中所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛。

①写出阳极所发生反应的电极反应式: 。
②在制备金属钛前后,CaO的总量不变,其原因是(请结合反应式解释) 。