题目内容
【题目】碳元素形成的单质和化合物在化工、材料、医学等领域应用广泛,回答下列问题:
(1)区分金刚石和无定形碳最可靠的科学方法为___________。基态C原子核外未成对电子的数目为_____________。
(2)咖啡因结构为 。
。
①咖啡因中C原子的杂化形式为_________________。
②1 mol咖啡因中所含![]() 键数目为_________________。
键数目为_________________。
③咖啡因通常在水中的溶解度较小,加入适量![]() 能增大其在水中溶解度的原因为_________________。
能增大其在水中溶解度的原因为_________________。
④CH3+(甲基正离子)的立体构型为_________________。
(3)CO、NO、H2S均为生命体系气体信号分子。其中H、C、O、S的电负性由大到小的顺序为____________;N、O、S的第一电离能由大到小的顺序为________________。
(4)干冰可用于人工降雨。其熔点低于金刚石的原因为___________;若干冰的密度为1.56 g/cm3,立方晶胞参数为0.57 nm,则每个晶胞实际占用CO2的数目为_______。
【答案】X-射线衍射实验 2 sp3杂化、sp2杂化 25NA 物质![]() 中含有亲水基-OH、-COONa,增大了物质的水溶性,同时含有亲油基,增大了咖啡因的溶解性,因此
中含有亲水基-OH、-COONa,增大了物质的水溶性,同时含有亲油基,增大了咖啡因的溶解性,因此![]() 可增大其在水中溶解度 平面三角形 O>S>C>H N>O>S 干冰属于分子晶体,分子间以范德华力结合;金刚石属于原子晶体,原子间以共价键结合,范德华力比共价键弱,导致干冰的熔点比金刚石低。 4
可增大其在水中溶解度 平面三角形 O>S>C>H N>O>S 干冰属于分子晶体,分子间以范德华力结合;金刚石属于原子晶体,原子间以共价键结合,范德华力比共价键弱,导致干冰的熔点比金刚石低。 4
【解析】
(1)区分晶体与非晶体最可靠的方法是X-射线衍射实验;结合构造原理及原子核外电子排布规律分析判断;
(2)①C原子形成共价单键为sp3杂化,形成共价双键为sp2杂化,加成判断;
②共价单键都是![]() 键,共价双键一个是
键,共价双键一个是![]() 键,一个是π键;
键,一个是π键;
③根据物质相似相溶原理分析判断;
(3)元素非金属性越强,其电负性就越大;元素的第一电离能随元素非金属性的增强而增大,第IIA、VA元素的元素大于相邻同一周期元素的第一电离能;
(4)不同类型晶体熔沸点规律是:原子晶体>离子晶体>分子晶体;根据晶胞参数及晶体密度,可计算晶胞质量,然后结合其相对分子质量计算含有的分子数目。
(1)区分晶体与非晶体最可靠的方法是X-射线衍射实验,金刚石是原子晶体,无定形碳是非晶体,所以区分金刚石和无定形碳最可靠的科学方法为X-射线衍射实验;
C原子核外有6个电子,核外电子排布式为1s22s22p2,由于一个轨道最多可容纳2个自旋方向相反的电子,2p轨道有3个,这2个电子总是尽可能占据不同轨道,而且自旋方向相同,这样能量最低,所以基态C原子有2个成单电子;
(2)①根据咖啡因分子结构示意图可知:分子中C原子有饱和C原子和形成羰基的C原子两种类型,饱和C采用sp3杂化,形成羰基的C原子采用sp2杂化;
②咖啡因分子式是C8H10N4O2,在一个咖啡因分子中含有的![]() 键数目是25个,则在1 mol咖啡因中所含
键数目是25个,则在1 mol咖啡因中所含![]() 键数目为25NA;
键数目为25NA;
③咖啡因分子中无亲水基,因此在水中不容易溶解;而在![]() 中同时含有亲水基和亲油基,含有亲水基-OH和-COONa增大了物质的水溶性,含有的亲油基(即憎水基)
中同时含有亲水基和亲油基,含有亲水基-OH和-COONa增大了物质的水溶性,含有的亲油基(即憎水基)![]() ,又能够很好溶解咖啡因,故加入适量
,又能够很好溶解咖啡因,故加入适量![]() 能增大咖啡因在水中的溶解度;
能增大咖啡因在水中的溶解度;
④CH3+中价电子数为3,采用sp2杂化,其空间构型为平面三角形;
(3)元素H、C、O、S的非金属性强弱顺序为:O>S>C>H,元素的非金属性越强,其电负性越大,所以这四种元素的电负性由大到小的顺序为:O>S>C>H;
在N、O、S三种元素中,原子半径越大,原子越容易失去电子,元素的电离能就越小。S元素原子半径最大,其第一电离能最小。对于同一周期的N、O两种元素来说,由于N原子最外层电子排布为半充满的稳定状态,失去电子比O难,因此第一电离能比O大,所以N、O、S三种元素的第一电离能由大到小的顺序N>O>S;
(4)干冰属于分子晶体,分子之间以微弱的范德华力结合,因此物质的熔沸点低,易气化,气化吸收大量热,使周围环境温度降低,水蒸气凝结为液体而降落,故可用于人工降雨;而金刚石属于原子晶体,C原子间以强烈的共价键结合,断裂消耗较高能量,所以其熔沸点比干冰高;
若干冰的密度为1.56 g/cm3,立方晶胞参数为0.57 nm,则根据m=ρ·V可得晶胞质量m(CO2)=ρ·V=1.56 g/cm3×(0.57 ×10-7 cm)3=2.89×10-22 g,由于CO2摩尔质量为44 g/mol,则每个晶胞实际占用CO2的数目为N(CO2)=![]() =4。
=4。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案【题目】某实验小组用0.50mol·L-1 NaOH溶液和0.50mol·L-1硫酸溶液进行反应热的测定。
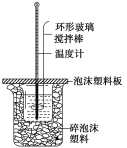
(1)写出该反应的热化学方程式[生成1 molH2O(l)时的反应热为-57.3 kJ·mol-1]:___。
(2)取50 mLNaOH溶液和30 mL 硫酸溶液进行实验,实验数据如表。
①请填写表中的空白:
温度 次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | ___ |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50mol·L-1NaOH溶液和0.50mol·L-1硫酸溶液的密度都是1.0g·mL-1,中和后生成溶液的比热容c=4.18J/(g·℃)。则生成1 mol H2O(l)时的反应热ΔH=___(取小数点后一位)。
③上述实验数值结果与-57.3kJ·mol-1有偏差,产生偏差的原因不可能是(填字母)___。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度