题目内容
【题目】氮氧化物(用NOx表示)是大气污染的重要因素,根据NOx的来源和性质特点,已开发出多种化学治理其污染的方法。
(1)汽车尾气中的NO2是城市大气污染的主要污染物之一。在日光照射下,NO2发生一系列光化学烟雾的循环反应,从而不断产生O3,加重空气污染。反应过程为①2NO2→2NO+2O,②2NO+O2→2NO2,③O+O2→O3。下列关于该反应过程及生成物的叙述正确的是____(填序号)。
A.NO2起催化作用
B.NO起催化作用
C.NO2只起氧化作用
D.O3与O2互为同素异形体
(2)汽车尾气中的CO来自于____,NO来自于____。
(3)汽车尾气中的CO、NOx可在适宜温度下采用催化转化法处理,使它们相互反应生成参与大气循环的无毒气体。写出NO被CO还原的化学方程式:_____。
(4)工业尾气中氮氧化物常采用碱液吸收法处理。NO2被烧碱溶液吸收时,生成两种钠盐,其物质的量之比为1∶1,该反应的离子方程式为____;1molNO2被完全吸收时,转移电子的物质的量为____。NO与NO2按物质的量之比1∶1被足量NaOH溶液完全吸收后只得到一种钠盐,该钠盐的化学式为____。
【答案】AD 汽油的不完全燃烧 N2与O2在汽车气缸内高温环境下的反应 2CO+2NO![]() N2+2CO2 2NO2+2OH-=NO3-+NO2-+H2O 0.5mol NaNO2
N2+2CO2 2NO2+2OH-=NO3-+NO2-+H2O 0.5mol NaNO2
【解析】
(1)A. 由①+②+③可得总反应:3O2=2O3,说明氮的NO2起催化作用,NO是反应中间体;
(2)汽车尾气中的CO来自于汽油燃料的不完全燃烧;NO来自于高温(或放电)条件下空气中的N2与O2反应;
(3)CO被NO氧化为参与大气循环的无毒气体CO2,本身被还原为N2,根据得失电子守恒可配平方程式;
(4)NO2被烧碱溶液吸收时,生成两种钠盐,其物质的量之比为1:1,说明NO2发生歧化反应。该反应的离子方程式为: 2NO2+2OH-=NO3-+NO2-+H2O,以此解答。
(1)A. 由①+②+③可得总反应:3O2=2O3,说明氮的NO2起催化作用,NO是反应中间体,故A正确,B、C错误;O3与O2互为同素异形体,故D正确;故选AD;
(2)汽车尾气中的CO来自于汽油燃料的不完全燃烧;NO来自于高温(或放电)条件下空气中的N2与O2反应;
(3)CO被NO氧化为参与大气循环的无毒气体CO2,本身被还原为N2,化学方程式:2CO+2NO N2+2CO2;
N2+2CO2;
(4)NO2被烧碱溶液吸收时,生成两种钠盐,其物质的量之比为1:1,说明NO2发生歧化反应。该反应的离子方程式为: 2NO2+2OH-=NO3-+NO2-+H2O;反应中2mol NO2反应转移1mol电子,则1mol NO2被完全吸收时,转移电子的物质的量为0.5mol; NO与NO2物质的量之比1:1,可以看成是N2O3,被NaOH溶液完全吸收后只得到亚硝酸盐,化学式为NaNO2。

【题目】已知2A(g)+B(g) ![]() 2C(g),△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2molA和1molB,在500℃时充分反应达平衡后C的浓度为ωmol/L,放出热量为b kJ。
2C(g),△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2molA和1molB,在500℃时充分反应达平衡后C的浓度为ωmol/L,放出热量为b kJ。
(1)比较a___b(填“>”“=”或“<”)。
(2)下表为不同温度下该反应的平衡常数。由此可推知,表中T1____T2(填“>” “=”或“<”)。
T/K | T1 | T2 | T3 |
K | 1.00×107 | 2.45×105 | 1.88×103 |
若在原来的容器中,只加入2molC,500℃时充分反应达平衡后,吸收热量为c kJ,C的浓度___(填“>”、“=”或“<”)ωmol/L,a、b、c之间满足何种关系_______(用代数式表示)。
(3)在相同条件下要想得到2a kJ热量,加入各物质的物质的量可能是_____。
A.4molA和2molB B.4molA、2molB和2molC C.4molA和4molB D.6molA和4molB
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是____。
A.及时分离出C气体 B.适当升高温度 C.增大B的浓度 D.选择高效催化剂
(5)若将上述容器改为恒压容器(反应前体积相同),起始时加入2molA和1molB,500℃时充分反应达平衡后,放出热量为d kJ,则d_____b(填“>”“=”或“<”),理由是_________。
(6)在一定温度下,向一个容积可变的容器中,加入3molA和2molB及固体催化剂,使之反应:2A(g)+B(g)![]() 2C(g),平衡时容器内气体物质的量为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4molA、3molB和2molC,则平衡时A的百分含量_____(填“不变”“变大”“变小”或“无法确定”)。
2C(g),平衡时容器内气体物质的量为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4molA、3molB和2molC,则平衡时A的百分含量_____(填“不变”“变大”“变小”或“无法确定”)。
【题目】二氧化硫是硫的重要化合物,在生产、生活中有广泛应用。二氧化硫有毒,并且是形成酸雨的主要气体。无论是实验室制备还是工业生产,二氧化硫尾气吸收或烟气脱硫都非常重要。
完成下列填空:
(1)实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫。
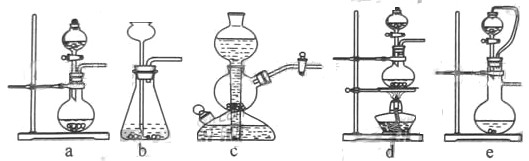
如果用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,上图中可选用的发生装置
是________(填写字母)。
(2)若用硫酸和亚硫酸钠反应制取3,36L(标准状况)二氧化硫,至少需要称取亚硫酸钠______g(保留一位小数);如果已有4.0%亚硫酸钠(质量分数),被氧化成硫酸钠,则至少需称取该亚硫酸钠______g (保留一位小数)。
(3)实验室二氧化硫尾气吸收与工业烟气脱硫的化学原理相通。石灰-石膏法和碱法是常用的烟气脱硫法。
石灰-石膏法的吸收反应为SO2+Ca(OH)2→CaSO3↓+H2O。吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO3+O2+4H2O→2CaSO4·2H2O。其流程如下图:
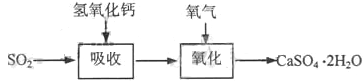
碱法的吸收反应为SO2+2NaOH→Na2SO3+H2O。碱法的特点是氢氧化钠碱性强、吸收快、效率高。其流程如下图:
已知:
试剂 | Ca(OH)2 | NaOH |
价格(元/kg) | 0.36 | 2.9 |
吸收SO2的成本(元/mol) | 0.027 | 0.232 |
石灰-石膏法和碱法吸收二氧化硫的化学原理相同之处是____________________。和碱法相比,石灰-石膏法的优点是________________,缺点是________________。
(4)在石灰-石膏法和碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案(用流程图表示)________________。