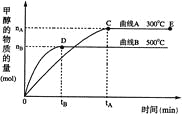
题目内容
【题目】实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验。
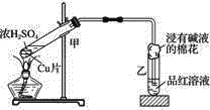
(1)判断铜与浓硫酸反应有二氧化硫生成所依据的现象是__________。
(2)甲装置中发生的主要反应的化学方程式是__________。
(3)装置乙中试管口放有一团浸有饱和碳酸钠溶液或氢氧化钠溶液的棉花,请写出二氧化硫与氢氧化钠溶液反应的离子方程式:_______。
(4)该反应中若有3.2 g 铜参加反应,则被还原硫酸的物质的量为______。
(5)含有0.2 mol 硫酸的浓硫酸,在加热时能否溶解6.4 g铜,结论和理由是______。
【答案】乙中品红溶液褪色 Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O 2OH-+SO2=
CuSO4+SO2↑+2H2O 2OH-+SO2=![]() +H2O 0.05 mol 不能完全溶解6.4 g铜,浓硫酸的浓度会随反应的进行减小,变为稀硫酸不再与铜反应
+H2O 0.05 mol 不能完全溶解6.4 g铜,浓硫酸的浓度会随反应的进行减小,变为稀硫酸不再与铜反应
【解析】
(1)二氧化硫具有漂白性,能使平衡褪色;
(2)甲装置中铜和浓硫酸在加热条件下发生反应生成二氧化硫、硫酸铜和水;
(3)二氧化硫属于大气污染物,为防止排入空气,需要在试管口放有一团浸有饱和碳酸钠溶液或氢氧化钠溶液的棉花,二氧化硫和氢氧化钠溶液反应生成亚硫酸钠。
(4)根据反应Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O计算;
CuSO4+SO2↑+2H2O计算;
(5)硫酸完全反应时需铜的质量=![]() ×64 g·mol-1=6.4 g,反应中实际溶解铜的质量小于6.4 g,因为随铜与浓硫酸反应的进行,浓硫酸的浓度减小,变为稀硫酸不再与铜反应,0.2 mol 硫酸不能完全反应。
×64 g·mol-1=6.4 g,反应中实际溶解铜的质量小于6.4 g,因为随铜与浓硫酸反应的进行,浓硫酸的浓度减小,变为稀硫酸不再与铜反应,0.2 mol 硫酸不能完全反应。
(1)判断铜与浓硫酸反应有二氧化硫生成,可利用二氧化硫具有漂白性,能使品红溶液褪色进行验证,若乙中品红溶液红色褪去,证明有二氧化硫产生,
故答案为:乙中品红溶液褪色;
(2)甲装置中铜和浓硫酸在加热条件下发生反应生成二氧化硫、硫酸铜和水,化学反应方程式:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O,
CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
(3)二氧化硫属于大气污染物,为防止排入空气,需要在试管口放有一团浸有饱和碳酸钠溶液或氢氧化钠溶液的棉花,二氧化硫和氢氧化钠溶液反应生成亚硫酸钠,离子反应方程式为:2OH-+SO2=![]() +H2O,
+H2O,
故答案为:2OH-+SO2=![]() +H2O;
+H2O;
(4)根据反应Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O可得,被还原的硫酸的物质的量=参与反应的铜的物质的量,3.2 g 铜的物质的量=
CuSO4+SO2↑+2H2O可得,被还原的硫酸的物质的量=参与反应的铜的物质的量,3.2 g 铜的物质的量=![]() =0.05mol,被还原的硫酸的物质的量=0.05mol,
=0.05mol,被还原的硫酸的物质的量=0.05mol,
故答案为:0.05mol;
(5)根据反应Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O可得,硫酸完全反应时需铜的质量=0.2 mol÷2×64 g·mol-1=6.4 g,因为随铜与浓硫酸反应的进行,浓硫酸的浓度减小,变为稀硫酸不再与铜反应,反应中实际溶解铜的质量小于6.4 g, 0.2 mol 硫酸不能完全反应,
CuSO4+SO2↑+2H2O可得,硫酸完全反应时需铜的质量=0.2 mol÷2×64 g·mol-1=6.4 g,因为随铜与浓硫酸反应的进行,浓硫酸的浓度减小,变为稀硫酸不再与铜反应,反应中实际溶解铜的质量小于6.4 g, 0.2 mol 硫酸不能完全反应,
故答案为:不能完全溶解6.4 g铜,浓硫酸的浓度会随反应的进行减小,变为稀硫酸不再与铜反应。