题目内容
【题目】(1)若1.92 g Cu粉与一定量浓HNO3反应,当Cu完全反应时,收集到标准状况下1.12L气体,则消耗硝酸________mol,生成NO2________mol;
(2)若向Cu中加入硫酸和硝酸的混酸溶液制取CuSO4溶液,则混酸中硫酸与硝酸的最佳物质的量之比为__________。
【答案】0.11 0.045 3∶2
【解析】
(1) 参加反应的HNO3包括被还原的HNO3和起酸性作用的HNO3,根据氮元素守恒计算消耗硝酸的物质的量;根据得失电子守恒计算生成NO2的物质的量;
(2) Cu、H+、NO3—按3Cu+8H++2NO3—=3Cu2++2NO+4H2O恰好完全反应时混酸中H2SO4和HNO3的比例最佳。
(1)参加反应的HNO3包括被还原的HNO3和起酸性作用的HNO3,根据氮元素守恒,表现酸性的HNO3为![]() ×2=0.06 mol,被还原的HNO3为
×2=0.06 mol,被还原的HNO3为![]() =0.05mol,故参加反应的HNO3为0.05mol+0.06 mol=0.11mol。
=0.05mol,故参加反应的HNO3为0.05mol+0.06 mol=0.11mol。
设标准状况下1.12 L气体中,含NOxmol、NO2ymol
则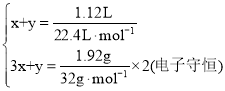
解之得![]() ,生成NO2 0.045mol。
,生成NO2 0.045mol。
(2)设H2SO4与HNO3的物质的量分别为x、y,根据方程式3Cu+8H++2NO3—=3Cu2++2NO↑+4H2O知![]() =4,x∶y=3∶2。
=4,x∶y=3∶2。

练习册系列答案
相关题目
【题目】下列描述和解释均正确且有对应关系的是( )
选项 | 描述 | 解释 |
A | 84消毒液可以消灭新型冠状病毒 |
|
B | 用灼烧法鉴别纤维素和聚乙烯塑料 | 纤维素有烧焦羽毛的气味 |
C | 《易经》载有“泽中有火”上火下泽” | 燃烧的气体可能为水煤气 |
D | 《四川盐法志》记载;当煮盐近于饱和时,往卤水中点加豆汁,至渣滓皆浮聚于面 | 加豆汁除渣利用了胶粒的吸附作用 |
A.AB.BC.CD.D