题目内容
2.为了证明醋酸是弱电解质,某同学开展了题为“醋酸是弱电解质的实验探究”的探究活动.该同学设计了如下方案,其中错误的是( )| A. | 先配制0.10 mol/L CH3COOH溶液,再测溶液的pH,若pH大于1,则可证明醋酸为弱电解质 | |
| B. | 先配制0.01 mol/L和0.10 mol/L的CH3COOH,再分别用pH计测它们的pH,若两者的pH相差小于1个单位,则可证明醋酸是弱电解质 | |
| C. | 取等体积、等pH的CH3COOH的溶液和盐酸分别与足量锌反应,测得反应过程中醋酸产生H2速率较慢且最终产生H2较多,则可证明醋酸为弱电解质 | |
| D. | 配制一定量的CH3COONa溶液,测其pH,若常温下pH大于7,则可证明醋酸是弱电解质 |
分析 要证明醋酸是弱电解质,可以根据一定物质的量浓度醋酸溶液的pH、醋酸钠溶液的酸碱性、浓度相差10倍的醋酸pH差值等判断,醋酸是弱电解质,在反应过程中会继续电离出离子,据此分析解答.
解答 解:A.先配制0.10 mol/L CH3COOH溶液,再测溶液的pH,若pH大于1,说明氢离子浓度小于醋酸浓度,则醋酸中存在电离平衡,所以可证明醋酸为弱电解质,故A不选;
B.先配制0.01 mol/L和0.10 mol/L的CH3COOH,再分别用pH计测它们的pH,如果醋酸是强电解质,则二者差值为1,若两者的pH相差小于1个单位,说明醋酸部分电离,溶液中存在电离平衡,所以可证明醋酸是弱电解质,故B不选;
C.取等体积、等pH的CH3COOH的溶液和盐酸分别与足量锌反应,最终醋酸产生H2较多,说明醋酸中存在电离平衡,醋酸在反应中继续电离出氢离子,所以反应过程中醋酸溶液中氢离子浓度大于盐酸,则醋酸反应速率较盐酸快,所以设计方案错误,故C选;
D.配制一定量的CH3COONa溶液,测其pH,若常温下pH大于7,说明醋酸钠是强碱弱酸盐,所以可证明醋酸是弱电解质,故D不选;
故选C.
点评 本题考查化学实验方案评价,为高频考点,要想证明醋酸是弱电解质,只要证明醋酸部分电离即可,ABD方法都可,注意电解质强弱与溶液导电能力无关,题目难度不大.

练习册系列答案
相关题目
13.下列说法正确的是( )
| A. | 乙烯的年产量通常用来衡量一个国家的石油化工发展水平 | |
| B. | 煤的干馏属于物理变化 | |
| C. | 石油裂化的主要目的是除去石油中的杂质 | |
| D. | 压缩天然气和液化石油气的主要成分均为一氧化碳 |
10.一定温度下,在甲、乙、丙三个恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示.下列判断中正确的是( )
| 甲 | 乙 | 丙 | ||
| 密闭容器体积/L | 2 | 2 | 2 | |
| 起始物质的量 | n(SO2)/mol | 0.40 | 0.80 | 0.80 |
| n(O2)/mol | 0.24 | 0.24 | 0.48 | |
| SO2的平衡转化率% | 80 | α1 | α2 | |
| A. | 该温度下,甲容器10min达到平衡,平均速率为v(SO3)=0.032 mol•L-1•min-1 | |
| B. | SO2的平衡转化率:α1<80% | |
| C. | 容器中SO3的物质的量浓度:2c(甲)>c(丙) | |
| D. | 甲中反应的平衡常数K为400 |
7.常温下,下列有关叙述正确的是( )
| A. | 饱和氯水中滴加NaOH至溶液呈中性:c(Na+)═2c(ClO-)+c(HClO) | |
| B. | 100ml 0.2mol/L的NH4Cl溶液和200ml 0.1mol/L的NH4Cl溶液所含有的n(NH4+)相同 | |
| C. | pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH-)≥c(H+) | |
| D. | 常温下,pH=4.75、浓度均为0.1mol/L的CH3COOH、CH3COONa混合溶液:c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+) |
14.某可逆反应当正反应速率增大时,下列说法正确的是( )
| A. | 逆反应速率一定增大 | B. | 平衡一定向正反应方向进行 | ||
| C. | 反应物的转化率一定增大 | D. | 该反应的条件一定发生变化 |
11.下列各组物质中,一定属于同系物的是( )
| A. | C2H4和C4H8 | B. | 苯和甲苯 | C. | 乙二醇和丙三醇 | D. |  和 和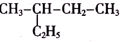 |
12.下列说法正确的是( )
| A. | CH3CH2 CH3的三个碳原子在一条直线 | |
| B. | CH2=CHCH3三个碳原子共平面 | |
| C. |  七个碳原子共平面 七个碳原子共平面 | |
| D. | CH4所有原子共平面 |
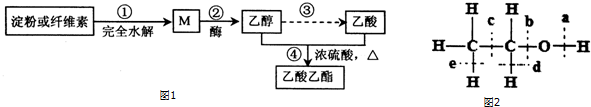
 CH3 CH2CO18OCH2CH3+H2O.
CH3 CH2CO18OCH2CH3+H2O.