题目内容
6.如图是元素周期表中的一部分,据此回答下列有关问题:
(1)写出只由①、②两元素形成的最简单的有机化合物的电子式
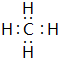 .
.(2)画出④元素简单离子的结构示意图
 .
.(3)某原子的结构示意图如右图所示
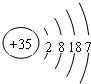 ,其在周期表中的位置为第四周期ⅦA族,该元素的符号为Br;上表中与其同主族的元素为氯(填元素名称),通过简单实验可比较这两种元素非金属性的强弱(实验简单、现象明显),写出该实验原理的离子反应方程式Cl2+2Br-=Br2+2Cl-.
,其在周期表中的位置为第四周期ⅦA族,该元素的符号为Br;上表中与其同主族的元素为氯(填元素名称),通过简单实验可比较这两种元素非金属性的强弱(实验简单、现象明显),写出该实验原理的离子反应方程式Cl2+2Br-=Br2+2Cl-.(4)⑤元素的最高价氧化物的水化物的化学式为NaOH,其中所含的化学键类型为离子键、共价键,该物质为离子化合物(填共价或离子).
(5)将⑦对应的单质投入稀硫酸中发生反应属于放热反应(填“吸热”或“放热”),若将⑦对应的单质和②对应的单质用导线连接后投入稀硫酸溶液中,组成的装置中化学能转化为电能,正极的电极反应式2H++2e-=H2↑.
(6)③、④两元素形成的化合物A为红棕色气体,将其密封于玻璃仪器中并加热会发现颜色变深,原因是存在平衡2NO2?N2O4,且正反应为放热反应,升高温度平衡向生成NO2的方向移动,NO2浓度增大.
分析 由元素在周期表中的位置可知:①为H,②为C,③为N,④为O,⑤为Na,⑥为Mg,⑦为Si,⑧为S,⑨为Cl.
(1)由①、②两元素形成的最简单的有机化合物为CH4;
(2)氧原子获得2个电子形成氧离子,离子核外电子数为10,有个电子层,各层电子数为2、8;
(3)原子的结构示意图为 ,处于第四周期ⅦA族,则为Br元素,表中与之同主族的元素为Cl,利用单质之间相互置换反应验证它们非金属性强;
,处于第四周期ⅦA族,则为Br元素,表中与之同主族的元素为Cl,利用单质之间相互置换反应验证它们非金属性强;
(4)⑤元素的最高价氧化物的水化物为NaOH;
(5)金属与酸的反应为放热反应;Al与碳单质用导线连接通入稀硫酸中组成原电池,正极发生还原反应,氢离子在正极获得电子生成氢气;
(6)③、④两元素形成的化合物A为红棕色气体,则A为NO2,存在平衡2NO2?N2O4,且正反应为放热反应.
解答 解:由元素在周期表中的位置可知:①为H,②为C,③为N,④为O,⑤为Na,⑥为Mg,⑦为Si,⑧为S,⑨为Cl.
(1)由①、②两元素形成的最简单的有机化合物为CH4,电子式为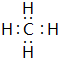 ,故答案为:
,故答案为: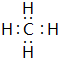 ;
;
(2)氧原子获得2个电子形成氧离子,离子核外电子数为10,有个电子层,各层电子数为2、8,结构示意图为 ,故答案为:
,故答案为: ;
;
(3)原子的结构示意图为 ,处于第四周期ⅦA族,则为Br元素,表中与之同主族的元素为Cl,利用单质之间相互置换反应验证它们非金属性强,反应离子方程式为:Cl2+2Br-=Br2+2Cl-,
,处于第四周期ⅦA族,则为Br元素,表中与之同主族的元素为Cl,利用单质之间相互置换反应验证它们非金属性强,反应离子方程式为:Cl2+2Br-=Br2+2Cl-,
故答案为:第四周期ⅦA族;Br;氯;Cl2+2Br-=Br2+2Cl-;
(4)⑤元素的最高价氧化物的水化物为NaOH,含有离子键、共价键,属于离子化合物,
故答案为:NaOH;离子键、共价键;离子;
(5)Al与硫酸的反应为放热反应;Al与碳单质用导线连接通入稀硫酸中组成原电池,化学能转化为电能,正极发生还原反应,氢离子在正极获得电子生成氢气,电极反应式为:2H++2e-=H2↑,
故答案为:放热;电能;2H++2e-=H2↑;
(6)③、④两元素形成的化合物A为红棕色气体,则A为NO2,存在平衡2NO2?N2O4,且正反应为放热反应,升高温度平衡向生成NO2的方向移动,NO2浓度增大,颜色加深,
故答案为:存在平衡2NO2?N2O4,且正反应为放热反应,升高温度平衡向生成NO2的方向移动,NO2浓度增大.
点评 本题考查元素周期表与元素周期律、常用化学用语、原电池、化学平衡等,侧重对基础知识的巩固,难度不大.

 名师点拨卷系列答案
名师点拨卷系列答案 在80℃时,0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中发生如下反应:N2O4?2NO2 △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
在80℃时,0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中发生如下反应:N2O4?2NO2 △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:| 时间(s)n(mol) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(2)80℃该反应的平衡常数K=1.8mol•L-1.
(3)反应进行至100s后将反应混合物的温度降低,混合气体的颜色变浅(填“变浅”、“变深”或“不变”).
(4)要增大该反应的K值,可采取的措施有(填序号)D,若要重新达到平衡时,使[NO2]/[N2O4]值变小,可采取的措施有(填序号)AB.
A.增大N2O4的起始浓度 B.向混合气体中通入NO2
C.使用高效催化剂 D.升高温度
(5)如图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60℃时N2O4物质的量的变化曲线.
| A. | .丙烷分子的比例模型: | B. | 丙烯的键线式: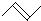 | ||
| C. | .醛基的电子式: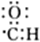 | D. | .甲醚的结构式: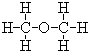 |
| 元素代号 | W | R | X | Y | Z |
| 原子半径/nm | 0.037 | 0.154 | 0.066 | 0.070 | 0.077 |
| 主要化合价 | +1 | +1 | -2 | -3、+5 | +2、+4 |
(1)五种元素中原子半径最大的元素是Na(填元素符号),画出该元素的原子结构示意图:
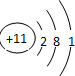
(2)W、X和Y可组成一化合物,其原子个数比为4:3:2,则该化合物属离子化合物(填“离子化合物”或“共价化合物”),存在的化学键是离子键、共价键.写出该化合物与由W、R和X按原子个数比为1:1:1组成化合物反应的化学方程式:NH4NO3+NaOH═NaNO3+NH3•H2O
(3)写出下列反应的化学方程式:Z的单质与Y元素的最高价氧化物对应的水化物反应:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
| A. | 制取粗硅 | B. | 用生石灰干燥氨气 | ||
| C. | 浓氨作制冷剂 | D. | 实验室中用棕色试剂瓶装浓HNO3 |
①加入AgNO3溶液 ②加入NaOH溶液 ③加热 ④用HNO3酸化溶液.
| A. | ①②③④ | B. | ②③④① | C. | ④③②① | D. | ②③①④ |