题目内容
13.为了鉴定溴乙烷中溴元素的存在,试分析下列各步实验,其中操作顺序合理的是( )①加入AgNO3溶液 ②加入NaOH溶液 ③加热 ④用HNO3酸化溶液.
| A. | ①②③④ | B. | ②③④① | C. | ④③②① | D. | ②③①④ |
分析 检验溴乙烷中溴元素,应在碱性条件下加热水解或碱性醇溶液条件下发生消去,最后加入硝酸酸化,加入硝酸银,观察是否有黄色沉淀生成,以此解答.
解答 解:检验溴乙烷中溴元素,应在碱性条件下加热水解或碱性醇溶液条件下发生消去,最后加入硝酸酸化,加入硝酸银,观察是否有黄色沉淀生成,所以操作顺序为②③④①.
故选B.
点评 本题考查溴乙烷的性质以及物质的检验,题目难度中等,易错点为卤代烃水解是碱性溶液中进行,加硝酸银时必须先加酸中和碱才能出现溴化银沉淀,注意实验的操作步骤.

练习册系列答案
相关题目
7.能实现 转变为的
转变为的 操作是( )
操作是( )
 转变为的
转变为的 操作是( )
操作是( )| A. | 先与NaOH溶液共热,再通人足量C02 | B. | 先与NaOH溶液共热,冉通人足量HC1 | ||
| C. | 先与稀H2S04共热,加人足量Na2CO3 | D. | 先与稀H2S04共热,加人足量NaOH |
8.已知某化学反应的平衡常数表达式为K=$\frac{c(C{O}_{2}).c({H}_{2})}{c(CO).c({H}_{2}O)}$,在不同的温度下该反应的平衡常数如下表:
下列有关叙述不正确的是( )
| t℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
| A. | 该反应的化学方程式是CO(g)+H2O(g)?CO2(g)+H2(g) | |
| B. | 上述反应的正反应是放热反应 | |
| C. | 增加CO,CO的平衡转化率增大 | |
| D. | 若平衡浓度符合关系$\frac{c(C{O}_{2})}{3c(CO)}$=$\frac{c({H}_{2}O)}{5c({H}_{2})}$,则此时的温度为1000℃ |
18.下列化合物在核磁共振氢谱中能出现两组峰,且其峰面积之比为2:1的有( )
| A. | 对苯二甲酸 | B. | 丙酸 | C. | 乙二醇 | D. | 乙酸 |
5.下列实验操作或所记录的数据合理的是( )
| A. | NaOH溶液可保存在玻璃塞的试剂瓶中 | |
| B. | 液溴应盛放在用水密封且用玻璃塞塞紧的棕色试剂瓶中 | |
| C. | 一学生用广泛pH试纸测得某浓度的稀盐酸pH为2.3 | |
| D. | 配制硫酸亚铁溶液,是将绿矾晶体溶于蒸馏水再加入一定量的铁粉 |
2.有一种新型燃料电池,工作时在一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-.现用该燃料电池和惰性电极电解Na2SO4溶液一段时间,假设电解时温度不变,下列说法不正确的是( )
| A. | 在熔融电解质中,O2-由正极移向负极 | |
| B. | 电解一共生成0.9 mol气体时,理论上消耗0.1 mol丁烷 | |
| C. | 电解池的阳极反应式为4OH--4e-═2H2O+O2↑ | |
| D. | 通入空气的一极是正极,电极反应式为O2+4e-═2O2- |
3.用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 46g乙醇中含有的化学键数为7NA | |
| B. | 1mol氯气和足量NaOH溶液反应转移电子数为2NA | |
| C. | 1mol OH- 和1 mol-OH(羟基)中含有的质子数均为9NA | |
| D. | 10L 0.1 mol•L-1 的Na2CO3溶液中,Na+、CO32- 总数为3NA |

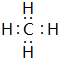 .
. .
.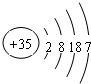 ,其在周期表中的位置为第四周期ⅦA族,该元素的符号为Br;上表中与其同主族的元素为氯(填元素名称),通过简单实验可比较这两种元素非金属性的强弱(实验简单、现象明显),写出该实验原理的离子反应方程式Cl2+2Br-=Br2+2Cl-.
,其在周期表中的位置为第四周期ⅦA族,该元素的符号为Br;上表中与其同主族的元素为氯(填元素名称),通过简单实验可比较这两种元素非金属性的强弱(实验简单、现象明显),写出该实验原理的离子反应方程式Cl2+2Br-=Br2+2Cl-.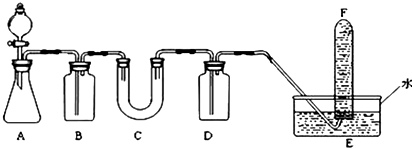
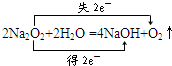 ,所以
,所以