题目内容
17.工业生产硫酸过程中存在反应2SO2(g)+O2(g)?2SO3(g),请回答下列问题:(1)已知上述反应过程中释放能量.反应过程中,断裂1molSO2中的化学键消耗的能量为Q1kJ,断裂1molO2中的化学键消耗的能量为Q2kJ,形成1molSO3中的化学键释放的能量为Q3kJ.则Q1、Q2、Q3的关系为2Q1+Q2<2Q3
(2)向一密闭容器中充入S18O2与O2,反应达到平衡时,含有18O的物质有3种.
分析 (1)据反应热中能量变化=旧键断裂吸收的总能量-新键形成释放的总能量来计算该反应的能量变化,氢气在氧气中燃烧,该反应放热,即旧键断裂吸收的总能量小于新键形成释放的总能量,据此解答;
(2)反应是可逆反应不能进行进行彻底,18O存在于所有含氧物质中.
解答 解:(1)工业生产硫酸过程中存在反应,2SO2(g)+O2(g)?2SO3(g),旧键断裂吸收的总能量为:2Q1KJ+Q2KJ,新键形成释放的总能量为:2Q3KJ;由于该反应放热,旧键断裂吸收的总能量小于新键形成释放的总能量,所以2Q1+Q2<2Q3;
故答案为:2Q1+Q2<2Q3;
(2)因为2SO2+O2?2SO3是可逆反应不能进行彻底,所以反应后18O存在于SO2、O2、SO3中,
故答案为:3.
点评 本题考查了化学平衡的分析判断,抓住可逆反应不能进行进行彻底,掌握基础是关键,题目难度中等.

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案
相关题目
8.在室温条件下,如下方法配制溶液,其浓度正确的是( )
| A. | 1mol Na2CO3固体溶于1L水中配成溶液,其物质的量浓度为1mol/L | |
| B. | 40g NaOH固体溶于100g水,配成的溶液质量百分比浓度为40% | |
| C. | 22.4L氨气溶于水配成1L溶液,其物质的量浓度为1mol/L | |
| D. | 1mol NaCl固体溶于水配成1L溶液,其物质的量浓度为1mol/L |
5.下列关于对卤素元素性质的比较说法中正确的是( )
| A. | 从上到下氢化物的熔沸点逐渐升高 | |
| B. | 从上到下单质的还原性逐渐减弱 | |
| C. | 从上到下最高价氧化物的水化物酸性逐渐减弱 | |
| D. | 从上到下原子得电子的能力逐渐增强 |
2.现有部分短周期元素的性质或原子结构如下表:
(1)用化学用语回答下列问题:
①A元素在周期表中的位置第三周期ⅥA族;
②B元素原子结构示意图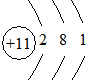 ;
;
③C单质分子的电子式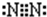 ;用电子式表示A和B元素组成的化合物的形成过程
;用电子式表示A和B元素组成的化合物的形成过程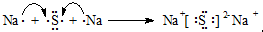 ;
;
④D元素在自然界有两种核素,用原子符号表示其中子数为20的核素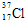 .
.
(2)元素D与元素A相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是bde(填选项序号).
a.常温下D的单质和A的单质状态不同
b.D的氢化物比A的氢化物稳定
c.一定条件下D和A的单质都能与钠反应
d.A的最高价含氧酸酸性弱于D的最高价含氧酸
e.D单质能与A的氢化物反应生成A单质
(3)探寻物质的性质差异性是学习的重要方法之一.A、B、C、D四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种的是NaOH(写化学式).
(4)X是由A、B、C、D四种元素中的某种元素组成的单质,能经下图所示的过程转化为W(其他条件略去).
X$\stackrel{O_{2}}{→}$Y$\stackrel{O_{2}}{→}$Z$\stackrel{H_{2}O}{→}$W
①若Y是有刺激性气味的无色气体,把Y通入BaCl2溶液中,然后滴加适量H2O2溶液,有白色沉淀生成,此白色沉淀的化学式为:BaSO4;生成该白色沉淀的化学方程式为BaCl2+SO2+H2O2=BaSO4↓+2HCl(或Ba2++SO2+H2O2=BaSO4↓+2H+);
②若Z是红棕色气体,则Z→W的反应中氧化剂与还原剂物质的量之比为:1:2.
| 元素编号 | 元素性质或原子结构 |
| A | 有三个电子层,K、M层电子数之和等于L层电子数 |
| B | 短周期中金属性最强 |
| C | 常温下单质为双原子分子,氢化物的水溶液呈碱性 |
| D | 元素最高正价是+7价 |
①A元素在周期表中的位置第三周期ⅥA族;
②B元素原子结构示意图
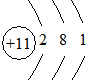 ;
;③C单质分子的电子式
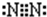 ;用电子式表示A和B元素组成的化合物的形成过程
;用电子式表示A和B元素组成的化合物的形成过程 ;
;④D元素在自然界有两种核素,用原子符号表示其中子数为20的核素
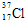 .
.(2)元素D与元素A相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是bde(填选项序号).
a.常温下D的单质和A的单质状态不同
b.D的氢化物比A的氢化物稳定
c.一定条件下D和A的单质都能与钠反应
d.A的最高价含氧酸酸性弱于D的最高价含氧酸
e.D单质能与A的氢化物反应生成A单质
(3)探寻物质的性质差异性是学习的重要方法之一.A、B、C、D四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种的是NaOH(写化学式).
(4)X是由A、B、C、D四种元素中的某种元素组成的单质,能经下图所示的过程转化为W(其他条件略去).
X$\stackrel{O_{2}}{→}$Y$\stackrel{O_{2}}{→}$Z$\stackrel{H_{2}O}{→}$W
①若Y是有刺激性气味的无色气体,把Y通入BaCl2溶液中,然后滴加适量H2O2溶液,有白色沉淀生成,此白色沉淀的化学式为:BaSO4;生成该白色沉淀的化学方程式为BaCl2+SO2+H2O2=BaSO4↓+2HCl(或Ba2++SO2+H2O2=BaSO4↓+2H+);
②若Z是红棕色气体,则Z→W的反应中氧化剂与还原剂物质的量之比为:1:2.
7.能实现 转变为的
转变为的 操作是( )
操作是( )
 转变为的
转变为的 操作是( )
操作是( )| A. | 先与NaOH溶液共热,再通人足量C02 | B. | 先与NaOH溶液共热,冉通人足量HC1 | ||
| C. | 先与稀H2S04共热,加人足量Na2CO3 | D. | 先与稀H2S04共热,加人足量NaOH |
 现有A、B、C三种短周期元素,原子序数依次递增.A与C的质子数之和为27,最外层电子数之差为5;0.9g单质B与足量盐酸反应,收集到气体1.12L(标准状况).请回答下列问题:
现有A、B、C三种短周期元素,原子序数依次递增.A与C的质子数之和为27,最外层电子数之差为5;0.9g单质B与足量盐酸反应,收集到气体1.12L(标准状况).请回答下列问题:

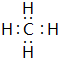 .
. .
.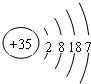 ,其在周期表中的位置为第四周期ⅦA族,该元素的符号为Br;上表中与其同主族的元素为氯(填元素名称),通过简单实验可比较这两种元素非金属性的强弱(实验简单、现象明显),写出该实验原理的离子反应方程式Cl2+2Br-=Br2+2Cl-.
,其在周期表中的位置为第四周期ⅦA族,该元素的符号为Br;上表中与其同主族的元素为氯(填元素名称),通过简单实验可比较这两种元素非金属性的强弱(实验简单、现象明显),写出该实验原理的离子反应方程式Cl2+2Br-=Br2+2Cl-.