题目内容
18.湿法炼锌的冶炼过程可用如图简略表示: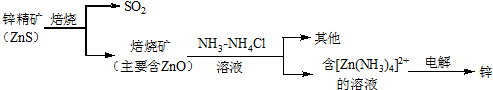
请回答下列问题:
(1)已知:N2H4(l)═N2(g)+2H2(g)△H=a kJ•mol-1,该反应不能自发进行,则a>0(填“>”、“<”或“=”).
(2)ZnS焙烧的反应2ZnS+3O2$\frac{\underline{\;焙烧\;}}{\;}$2SO2+2ZnO所涉及的物质中,发生氧化反应的物质是ZnS;已知ZnO属于两性氧化物,写出ZnO与NaOH溶液反应的化学方程式:2NaOH+ZnO=Na2ZnO2+H2O.
(3)电解过程中析出锌的电极反应式为[Zn(NH3)4]2++2e-=Zn+4NH3↑.
(4)产生的SO2可用Ba(NO3)2溶液吸收,部分产物可作为工业原料,其反应的离子方程式为3SO2+2H2O+2NO3-+3Ba2+=3BaSO4↓+2NO↑+4H+.
(5)锌-空气电池与锂电池相比,具有储存电量高、成本低、没有安全隐患等优点.该电池的总反应为2Zn+O2═2ZnO,电解质溶液为KOH溶液,则负极的电极反应式为Zn+2OH--2e-=ZnO+H2O.25℃时,以该电池为电源,用两个等质量的铜棒作电极电解500mL 0.1mol/L CuSO4溶液,一段时间后切断电源,对电极干燥并称量,测得两电极的质量差为9.6g,则至少需要4.2L空气(折算成标准状况)进入该电池.
(6)已知一个电子的电量是1.602×10-19C,用上述电池电解饱和食盐水,当电路中通过1.929×105C的电量时,生成NaOH80g.
分析 锌精矿焙烧得到二氧化硫和ZnO,将ZnO加入NH3-NH4Cl溶液中,发生反应得到[Zn(NH3)4]Cl2,电解[Zn(NH3)4]Cl2溶液得到Zn,
(1)吸热的熵减的反应在任何条件下都不能自发进行;
(2)ZnS焙烧的反应2ZnS+3O2$\frac{\underline{\;焙烧\;}}{\;}$2SO2+2ZnO所涉及的物质中,S元素化合价由-2价变为+4价、O元素化合价由0价变为-2价,失电子的物质发生氧化反应;
ZnO属于两性氧化物,ZnO与NaOH溶液反应生成偏锌酸钠和水;
(3)电解过程中析出锌的电极上[Zn(NH3)4]2+ 得电子发生还原反应;
(4)产生的SO2可用Ba(NO3)2溶液吸收,二氧化硫具有还原性,能被氧化生成硫酸根离子,硫酸根离子和钡离子反应生成硫酸钡沉淀;
(5)锌-空气电池与锂电池相比,具有储存电量高、成本低、没有安全隐患等优点.该电池的总反应为2Zn+O2═2ZnO,电解质溶液为KOH溶液,负极上Zn失电子和氢氧根离子反应生成ZnO和水;
根据转移电子相等计算消耗空气体积;
(6)已知一个电子的电量是1.602×10-19C,用上述电池电解饱和食盐水,当电路中通过1.929×105C的电量时,转移电子个数=$\frac{1.929×1{0}^{5}C}{1.602×1{0}^{-19}C}$=1.204×1024,则转移电子物质的量为2mol,根据转移电子和NaOH之间的关系式计算氢氧化钠质量.
解答 解:锌精矿焙烧得到二氧化硫和ZnO,将ZnO加入NH3-NH4Cl溶液中,发生反应得到[Zn(NH3)4]Cl2,电解[Zn(NH3)4]Cl2溶液得到Zn,
(1)N2H4(l)═N2(g)+2H2(g)△H=a kJ•mol-1,该反应不能自发进行,说明△G=△H-T△S>0,该反应是熵增的反应,则△S>0,则a>0,
故答案为:>;
(2)ZnS焙烧的反应2ZnS+3O2$\frac{\underline{\;焙烧\;}}{\;}$2SO2+2ZnO所涉及的物质中,S元素化合价由-2价变为+4价、O元素化合价由0价变为-2价,失电子的物质发生氧化反应,则发生氧化反应的物质是ZnS;
ZnO属于两性氧化物,ZnO与NaOH溶液反应生成偏锌酸钠和水,反应方程式为2NaOH+ZnO=Na2ZnO2+H2O,
故答案为:ZnS;2NaOH+ZnO=Na2ZnO2+H2O;
(3)电解过程中析出锌的电极上[Zn(NH3)4]2+ 得电子发生还原反应,电极反应式为[Zn(NH3)4]2++2e-=Zn+4NH3↑,故答案为:[Zn(NH3)4]2++2e-=Zn+4NH3↑;
(4)产生的SO2可用Ba(NO3)2溶液吸收,二氧化硫具有还原性,能被氧化生成硫酸根离子,硫酸根离子和钡离子反应生成硫酸钡沉淀,离子反应方程式为3SO2+2H2O+2NO3-+3Ba2+=3BaSO4↓+2NO↑+4H+,
故答案为:3SO2+2H2O+2NO3-+3Ba2+=3BaSO4↓+2NO↑+4H+;
(5)锌-空气电池与锂电池相比,具有储存电量高、成本低、没有安全隐患等优点.该电池的总反应为2Zn+O2═2ZnO,电解质溶液为KOH溶液,负极上Zn失电子和氢氧根离子反应生成ZnO和水,电极反应式为Zn+2OH--2e-=ZnO+H2O;
以该电池为电源,用两个等质量的铜棒作电极电解500mL 0.1mol/L CuSO4溶液,阳极上是Cu-2e-=Cu2+,阴极上是Cu2++2e-=Cu,对电极干燥并称量,测得两电极的质量差为9.6g,则减少的铜和生成的铜各是4.8g即0.075mol,转移电子是0.15mol,根据反应2Zn+O2═2ZnO,当转移电子是4mol时,消耗氧气是1moL,所以转移电子是0.15mol时,消耗氧气是0.0375moL,氧气体积是空气提及的五分之一,所以消耗空气的体积是0.0375moL×5×22.4L/mol=4.2L;
故答案为:Zn+2OH--2e-=ZnO+H2O;4.2;
(6)已知一个电子的电量是1.602×10-19C,用上述电池电解饱和食盐水,当电路中通过1.929×105C的电量时,转移电子个数=$\frac{1.929×1{0}^{5}C}{1.602×1{0}^{-19}C}$=1.204×1024,则转移电子物质的量为2mol,转移电子和NaOH之间的关系式为2e----2NaOH,当转移2mol电子时生成2molNaOH,则m(NaOH)=2mol×40g/mol=80g,
故答案为:80.
点评 本题以物质制备为载体考查电解原理、氧化还原反应等知识点,为高频考点,明确物质性质及各个电极上发生的反应是解本题关键,注意利用转移电子守恒进行相关计算,易错点是(4)题,二氧化硫和硝酸钡溶液反应发生氧化还原反应生成硫酸钡而不是生成亚硫酸钡,题目难度中等.

| A. | 1mol Na2CO3固体溶于1L水中配成溶液,其物质的量浓度为1mol/L | |
| B. | 40g NaOH固体溶于100g水,配成的溶液质量百分比浓度为40% | |
| C. | 22.4L氨气溶于水配成1L溶液,其物质的量浓度为1mol/L | |
| D. | 1mol NaCl固体溶于水配成1L溶液,其物质的量浓度为1mol/L |
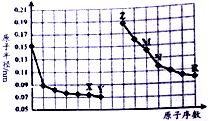
| A. | Y、R两种元素的气态氢化物稳定性大小:Y<R | |
| B. | 简单离子的半径:X>Z>M | |
| C. | 由X于N两种元素组成的化合物不能与任何酸反应,但能与强碱反应 | |
| D. | Z单质能从M与R元素构成的盐溶液中置换出单质M |
 转变为的
转变为的 操作是( )
操作是( )| A. | 先与NaOH溶液共热,再通人足量C02 | B. | 先与NaOH溶液共热,冉通人足量HC1 | ||
| C. | 先与稀H2S04共热,加人足量Na2CO3 | D. | 先与稀H2S04共热,加人足量NaOH |
| A. | NaOH溶液可保存在玻璃塞的试剂瓶中 | |
| B. | 液溴应盛放在用水密封且用玻璃塞塞紧的棕色试剂瓶中 | |
| C. | 一学生用广泛pH试纸测得某浓度的稀盐酸pH为2.3 | |
| D. | 配制硫酸亚铁溶液,是将绿矾晶体溶于蒸馏水再加入一定量的铁粉 |
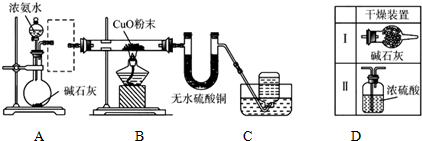

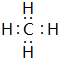 .
. .
.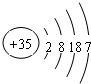 ,其在周期表中的位置为第四周期ⅦA族,该元素的符号为Br;上表中与其同主族的元素为氯(填元素名称),通过简单实验可比较这两种元素非金属性的强弱(实验简单、现象明显),写出该实验原理的离子反应方程式Cl2+2Br-=Br2+2Cl-.
,其在周期表中的位置为第四周期ⅦA族,该元素的符号为Br;上表中与其同主族的元素为氯(填元素名称),通过简单实验可比较这两种元素非金属性的强弱(实验简单、现象明显),写出该实验原理的离子反应方程式Cl2+2Br-=Br2+2Cl-.
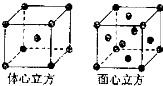 Mn、Fe均为第四周期过渡元素.请回答下列问题:
Mn、Fe均为第四周期过渡元素.请回答下列问题: