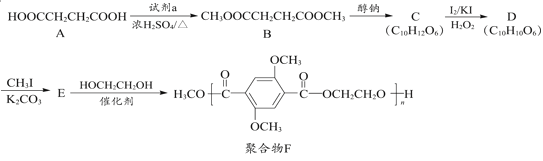
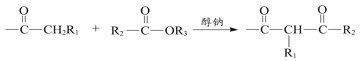题目内容
【题目】某厂用闪锌矿制备锌及颜料 A(红棕色固体)的工艺流程如下图所示。(闪锌矿的主要成分为 ZnS,同时含有 10%的 FeS 及少量 CuS)
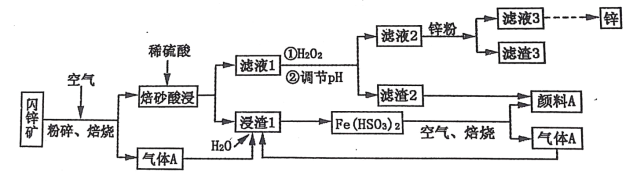
已知:①闪锌矿在焙烧时会生成副产物 ZnFeO4,ZnFeO4 不溶于水及硫酸。Fe(HSO3)2 难溶于水。②Ksp[Fe(OH)3]=1×10-39。
完成下列问题
(1)闪锌矿粉碎的目的是_______________________________________________________。
(2)“滤液 1”中选用足量的 H2O2,理由是_____________________。假设“②调节 pH"前,滤液 1 中 c(Fe3+)=1molL-1 ,则 Fe3+ 完全沉淀时的 pH 至少为____________________。(离子浓度≤ 10-6mol·L-1 规为完全除去)。
(3)“滤渣 3”的成分为__________________________________ (写化学式)。
(4)设计一种检验“颜料 A”中是否含有 Fe2+的实验方案_______________________________________________________。
(5)“气体 A”与“浸渣 1”反应的化学方程式为_______________________________________________________。
【答案】增大固体不氧气的接触面积,提高反应速率。 将Fe2+完全氧化成Fe3+,避免引入杂质 3 Zn和Cu或者Cu 取少量固体A于试管中,加入稀硫酸完全溶解后,滴加酸性KMnO4紫红色褪色,则含有Fe2+ 4SO2+ZnFeO4+2H2O=Fe(HSO3)2+ ZnSO4+H2SO4
【解析】
(1)闪锌矿粉碎的目的是增大固体不氧气的接触面积,提高反应速率。
(2)“滤液 1”中选用足量的 H2O2,理由是将 Fe2+完全氧化成 Fe3+,避免引入杂质。假设“②调节 pH前,滤液1中 c(Fe3+)=1molL-1 ,则Fe3+完全沉淀时,![]() ,
,![]() ,
,![]() ,pH = 3。
,pH = 3。
(3)由于滤液2中加入锌粉,其主要是将铜离子置换出来,锌可能可能,因此“滤渣3”的成分为Zn和Cu或者Cu。
(4)设计一种检验“颜料A”中是否含有Fe2+的实验方案,主要将固体A溶于稀硫酸中,再用酸性高锰酸钾来验证亚铁离子。
(5)气体A为二氧化硫与浸渣1的ZnFeO4反应的化学方程式为4SO2+ZnFeO4+2H2O=Fe(HSO3)2+ ZnSO4+H2SO4。
(1)闪锌矿粉碎的目的是增大固体不氧气的接触面积,提高反应速率,故答案为:增大固体不氧气的接触面积,提高反应速率。
(2)“滤液 1”中选用足量的 H2O2,理由是将 Fe2+完全氧化成 Fe3+,避免引入杂质。假设“②调节 pH前,滤液1中 c(Fe3+)=1molL-1 ,则Fe3+完全沉淀时,![]() ,
,![]() ,
,![]() ,pH = 3,故答案为:将Fe2+完全氧化成Fe3+,避免引入杂质;3。
,pH = 3,故答案为:将Fe2+完全氧化成Fe3+,避免引入杂质;3。
(3)由于滤液2中加入锌粉,其主要是将铜离子置换出来,锌可能可能,因此“滤渣3”的成分为Zn和Cu或者Cu,故答案为:Zn和Cu或者Cu。
(4)设计一种检验“颜料A”中是否含有Fe2+的实验方案,主要将固体A溶于稀硫酸中,再用酸性高锰酸钾来验证亚铁离子,故答案为:取少量固体A于试管中,加入稀硫酸完全溶解后,滴加酸性KMnO4紫红色褪色,则含有Fe2+。
(5)气体A为二氧化硫与浸渣1的ZnFeO4反应的化学方程式为4SO2+ZnFeO4+2H2O=Fe(HSO3)2+ ZnSO4+H2SO4,故答案为:4SO2+ZnFeO4+2H2O=Fe(HSO3)2+ ZnSO4+H2SO4
。

【题目】下表是元素周期表的一部分,已知X元素的最高价氧化物的化学式为X2O5,且五种元素中有一种元素的原子半径在其所处的族中最小。
B | ||
A | X | C |
D |
请回答下列问题:
(1)X的元素符号是___________。
(2)D元素的最高正化合价是_______________。
(3)写出C的气态氢化物的电子式__________________________。
(4)写出工业上合成B的气态氢化物的化学方程式___________________________。