题目内容
【题目】从海水中提取金属镁的工艺流程可简单图示如下:

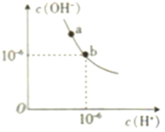
(1)步骤①的目的是将海水中的Mg2+沉淀为Mg(OH)2,若浓缩海水中c(Mg2+)=2.0 mol·L-1,Mg2+开始形成沉淀时溶液的pH约为________(已知Ksp[Mg(OH)2]=1.8×10-11,log3=0.48)
(2)步骤③的操作由蒸发浓缩,______,过滤,_______四个环节组成。
(3)步骤④是在HCl气流中加热晶体得到无水MgCl2,简要说明HCl气体的作用_________。
【答案】8.48 降温结晶 (冷却结晶也行) 洗涤干燥 抑制MgCl2水解,防止生成Mg(OH)Cl[或Mg(OH)2]
【解析】
(1)向含有MgCl2的海水中加入生石灰,Mg2+转化为Mg(OH)2沉淀,根据溶度积常数的含义计算Mg2+开始形成沉淀时OH-的浓度,再结合水的离子积常数计算溶液的pH;
(2)根据MgCl2的溶解度受温度的影响变化较大的性质分析解答;
(3)根据盐的水解规律分析。
Ksp[Mg(OH)2]=1.8×10-11,c(Mg2+)=2.0 mol/L,则c2(OH-)=1.8×10-11÷2.0=9×10-12,所以c(OH-)=3×10-6mol/L,由于在室温下水的离子积为Kw=1×10-14,则c(H+)=1×10-14÷3×10-6=![]() ×10-8mol/L,pH=-lgc(H+)=-lg
×10-8mol/L,pH=-lgc(H+)=-lg![]() ×10-8=8+0.48=8.48;
×10-8=8+0.48=8.48;
(2)步骤③是从MgCl2溶液中获得MgCl26H2O,由于MgCl2的溶解度受温度的影响变化较大,所以操作由蒸发浓缩,冷却结晶,过滤,洗涤干燥四个环节组成;
(3)氯化镁晶体加热,MgCl2会溶解在结晶水中,形成溶液,由于MgCl2是强酸弱碱盐,在溶液中发生水解反应产生Mg(OH)2或Mg(OH)Cl和HCl,HCl挥发,导致最后得到的是Mg(OH)2,根据盐的水解规律,在HCl气氛中加热,就可以抑制盐的水解,防止生成Mg(OH)Cl[或Mg(OH)2]。

【题目】以硅藻土为载体的五氧化二钒![]() 是接触法生成硫酸的催化剂。从废钒催化剂中回收
是接触法生成硫酸的催化剂。从废钒催化剂中回收![]() 既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 |
|
|
|
|
|
|
质量分数 |
|
|
|
|
|
|
以下是一种废钒催化剂回收工艺路线:
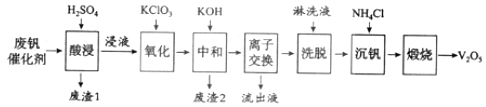
回答下列问题:
![]() 五氧化二钒是一种催化剂,可将
五氧化二钒是一种催化剂,可将![]() 转化为
转化为![]() ,请写出该反应的化学方程式______。
,请写出该反应的化学方程式______。
![]() “酸浸”时
“酸浸”时![]() 转化为
转化为![]() ,反应的离子方程式为______,同时
,反应的离子方程式为______,同时![]() 转成
转成![]() “废渣1”的主要成分是______。
“废渣1”的主要成分是______。
![]() “氧化”中欲使3mol的
“氧化”中欲使3mol的![]() 变为
变为![]() ,则需要氧化剂
,则需要氧化剂![]() 至少为______mol。
至少为______mol。
![]() “中和”作用之一是使钒以
“中和”作用之一是使钒以![]() 形式存在于溶液中。“废渣2”中含有______。
形式存在于溶液中。“废渣2”中含有______。
![]() “流出液”中阳离子最多的是______。
“流出液”中阳离子最多的是______。
![]() “沉钒”得到偏钒酸铵
“沉钒”得到偏钒酸铵![]() 沉淀,写出“煅烧”中发生反应的化学方程式______。
沉淀,写出“煅烧”中发生反应的化学方程式______。