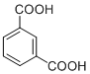
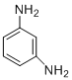
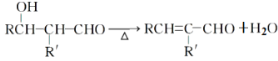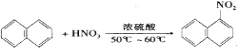题目内容
【题目】关于如图所示的原电池,下列说法正确的是( )
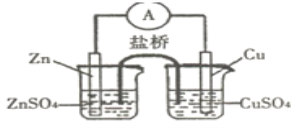
A.电子从锌电极通过电流表流向铜电极
B.盐桥中的阳离子向硫酸锌溶液中迁移
C.锌电极发生氧化反应,铜电极发生还原反应,其电极反应是2H+2e=H2↑
D.取出盐桥后,电流表仍会偏转,铜电极在反应前后质量不变
【答案】A
【解析】
原电池的两个电极材料中,锌比铜活泼,锌作负极,铜作正极,电子通过外电路从负极流向正极;盐桥中阴离子流向负极,阳离子流向正极;铜作正极,铜离子在正极得电子生成铜单质,据此判断。
A. 该原电池中较活泼的金属锌作负极,较不活泼的金属铜作正极,电子从锌电极通过电流计流向铜电极,故A正确;
B. 原电池放电时,盐桥中的阴离子向硫酸锌溶液中迁移,阳离子向硫酸铜溶液中迁移,故B错误;
C. 原电池放电时,锌作负极,锌失电子发生氧化反应,铜作正极,铜离子得电子发生还原反应在铜极上析出,电极反应式为Cu2++2e-=Cu,故C错误;
D. 取出盐桥后,不是闭合回路,没有电流产生,电流计不发生偏转,铜电极质量增加,故D错误;
答案选A。

 阅读快车系列答案
阅读快车系列答案【题目】以硅藻土为载体的五氧化二钒![]() 是接触法生成硫酸的催化剂。从废钒催化剂中回收
是接触法生成硫酸的催化剂。从废钒催化剂中回收![]() 既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 |
|
|
|
|
|
|
质量分数 |
|
|
|
|
|
|
以下是一种废钒催化剂回收工艺路线:
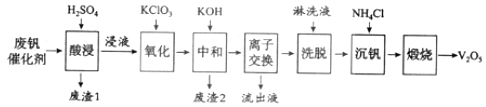
回答下列问题:
![]() 五氧化二钒是一种催化剂,可将
五氧化二钒是一种催化剂,可将![]() 转化为
转化为![]() ,请写出该反应的化学方程式______。
,请写出该反应的化学方程式______。
![]() “酸浸”时
“酸浸”时![]() 转化为
转化为![]() ,反应的离子方程式为______,同时
,反应的离子方程式为______,同时![]() 转成
转成![]() “废渣1”的主要成分是______。
“废渣1”的主要成分是______。
![]() “氧化”中欲使3mol的
“氧化”中欲使3mol的![]() 变为
变为![]() ,则需要氧化剂
,则需要氧化剂![]() 至少为______mol。
至少为______mol。
![]() “中和”作用之一是使钒以
“中和”作用之一是使钒以![]() 形式存在于溶液中。“废渣2”中含有______。
形式存在于溶液中。“废渣2”中含有______。
![]() “流出液”中阳离子最多的是______。
“流出液”中阳离子最多的是______。
![]() “沉钒”得到偏钒酸铵
“沉钒”得到偏钒酸铵![]() 沉淀,写出“煅烧”中发生反应的化学方程式______。
沉淀,写出“煅烧”中发生反应的化学方程式______。