��Ŀ����
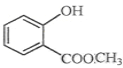
����Ŀ����ѧ�Һ�°������й����Ƽ�գ��ٽ��������Ƽ���ķ�չ����ͼ�Ǵ���յļ���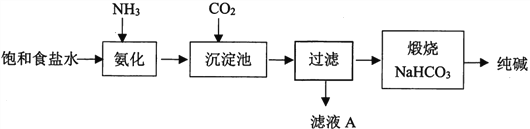
��1��д��CO2�ĵ���ʽ____________________��
��2�������ӷ���ʽ��ʾ�������HCO3-������___________________��
��3����ҵ����ʱ�Ȱ�����ͨCO2��˳���ܵߵ���ԭ����_______________��
��4����ҺA������Ҫ������������_________��
��5��ijС���������ʵ�������ҺA�е���Ҫ���ʡ���Һ©��������һ��ʱ����Թ����а�ɫ�������ɣ��û�ѧԭ�����Ͱ�ɫ���������ԭ��___________________��

��6��ij������Ʒ�����ղ���ֶ�������NaHCO3��ȡ����Ϊm1�Ĵ�����Ʒ����ּ��Ⱥ�����Ϊm2�������Ʒ��̼�����Ƶ���������Ϊ______________________��
���𰸡� ![]() CO2+NH3��H2O=HCO3��+NH4+ NH3��������ˮ����ͨNH3��ʹ�����CO2���䷴Ӧ��������c(NH4+)��c(HCO3-)��������NaHCO3��������� NH4+��Cl- ��ҺA�к��д���NH4+��Cl-������ʳ�Σ�����c(Cl-)��ͨ�백��������c(NH4+)��ʹƽ��NH4Cl(s)
CO2+NH3��H2O=HCO3��+NH4+ NH3��������ˮ����ͨNH3��ʹ�����CO2���䷴Ӧ��������c(NH4+)��c(HCO3-)��������NaHCO3��������� NH4+��Cl- ��ҺA�к��д���NH4+��Cl-������ʳ�Σ�����c(Cl-)��ͨ�백��������c(NH4+)��ʹƽ��NH4Cl(s) ![]() NH4+(aq)+ Cl-(aq)�����ƶ�����ʹ�Ȼ�什ᾧ�������¶Ƚ����������Ȼ�什ᾧ����
NH4+(aq)+ Cl-(aq)�����ƶ�����ʹ�Ȼ�什ᾧ�������¶Ƚ����������Ȼ�什ᾧ���� ![]()
����������1��CO2Ϊ���ۻ�������̼ԭ������ԭ�Ӽ��γ�˫����CO2�ĵ���ʽΪ![]() ����ȷ�𰸣�
����ȷ�𰸣�![]() ��
��
��2��������̼ͨ�백����ˮ��Һ����������Ӧ����̼����������ӷ���ʽΪ. CO2+NH3��H2O=HCO3��+NH4+ ����ȷ����CO2+NH3��H2O=HCO3��+NH4+��
��3��NH3��������ˮ����ͨNH3��ʹ�����CO2���䷴Ӧ��������c(NH4+)��c(HCO3-)��������NaHCO3��������������Թ�ҵ����ʱ�Ȱ�����ͨCO2����ȷ�𰸣�NH3��������ˮ����ͨNH3��ʹ�����CO2���䷴Ӧ��������c(NH4+)��c(HCO3-)��������NaHCO3�����������
��4��̼�������Һ���Ȼ�����Һ��Ϻ��������Ȼ�狀�̼�����������˺���ҺA����ҪΪ�Ȼ����Һ��������ҺA������Ҫ������������NH4+��Cl-����ȷ����NH4+��Cl-��
��5��Ũ��ˮ����ʯ�ҷ�Ӧ���ɰ������뵽�Ȼ�����Һ����ͨ�백��������c(NH4+)��ʹƽ��NH4Cl(s) ![]() NH4+(aq)+ Cl-(aq)�����ƶ�����ʹ�Ȼ�什ᾧ��������ҺA�к��д���NH4+��Cl-������ʳ�Σ�����c(Cl-)��ʹƽ��NH4Cl(s)
NH4+(aq)+ Cl-(aq)�����ƶ�����ʹ�Ȼ�什ᾧ��������ҺA�к��д���NH4+��Cl-������ʳ�Σ�����c(Cl-)��ʹƽ��NH4Cl(s) ![]() NH4+(aq)+ Cl-(aq)�����ƶ�����ʹ�Ȼ�什ᾧ�������¶Ƚ����������Ȼ�什ᾧ��������ȷ�𰸣���ҺA�к��д���NH4+��Cl-������ʳ�Σ�����c(Cl-)��ͨ�백��������c(NH4+)��ʹƽ��NH4Cl(s)
NH4+(aq)+ Cl-(aq)�����ƶ�����ʹ�Ȼ�什ᾧ�������¶Ƚ����������Ȼ�什ᾧ��������ȷ�𰸣���ҺA�к��д���NH4+��Cl-������ʳ�Σ�����c(Cl-)��ͨ�백��������c(NH4+)��ʹƽ��NH4Cl(s) ![]() NH4+(aq)+ Cl-(aq)�����ƶ�����ʹ�Ȼ�什ᾧ�������¶Ƚ����������Ȼ�什ᾧ���� ��
NH4+(aq)+ Cl-(aq)�����ƶ�����ʹ�Ȼ�什ᾧ�������¶Ƚ����������Ȼ�什ᾧ���� ��
��6��![]() ���ɷ���ʽ��֪��2mol
���ɷ���ʽ��֪��2mol![]() ��Ӧ����Ӧǰ����������ͼ���
��Ӧ����Ӧǰ����������ͼ���![]() ����ô���з�Ӧǰ���������������m1-m2��g,��Ҫ
����ô���з�Ӧǰ���������������m1-m2��g,��Ҫ![]() ������Ϊx=84��m1-m2��/31, ���������ʽ�ɵã���(NaHCO3)= x/ m1��100%=
������Ϊx=84��m1-m2��/31, ���������ʽ�ɵã���(NaHCO3)= x/ m1��100%=![]() ����ȷ�𰸣�
����ȷ�𰸣�![]() ��
��

����Ŀ����X��Y��Z��W���ֶ���������Ԫ�أ�ԭ��������������Ԫ��������ԭ�ӣ���������ṹ���±���ʾ��
Ԫ�ر�� | Ԫ��������ԭ�ӣ���������ṹ |
X | ԭ�Ӻ���û������ |
Y | �����µ���Ϊ˫ԭ�ӷ��ӣ������к���3�Թ��õ��Ӷ� |
Z | ���ڲ��������������2�� |
W | ������Ԫ����ԭ�Ӱ뾶��С |
��ش�
��1��д��Ԫ��Z�����ڱ��е�λ��______������Ԫ��W��ԭ�ӽṹʾ��ͼ______��
��2��Y��W��ȣ���̬�⻯���ȶ��Խ�������________���ѧʽ����ͬ������Ԫ������������Ӧˮ�������Ը�ǿ����__________��
��3��X��Y��Z����Ԫ�ؿ����γɻ�����ZYX2�����뻯����XW������Ӧ�����������Σ�д���÷�Ӧ�Ļ�ѧ����ʽ________________��
����Ŀ��̽���糡�������������ӵ�Ǩ�ơ�a��b��c��d ��Ϊʯī�缫���缫���4cm����pH��ֽ�ò�ͬŨ��Na2SO4��Һ�����ʪ����������ʵ�飺
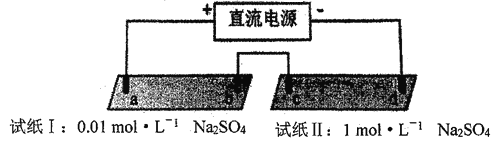
ʵ������
ʱ�� | ��ֽI | ��ֽII |
lmin | a��������ֽ��죬b��������ֽ���� | c��������ֽ��죬d���������� |
10min | ��ɫ������ɫ���������м���չ������ʱ��ɫ��Լ2.7cm����ɫ��Լ1.3cm | ������ɫ��Χ�������ԣ���ֽ����Ϊ��ɫ |
����˵������ȷ����
A. d��������ֽ����
B. a��������ֽ����ԭ���ǣ�2H2O+2e-= H2��+2OH-
C. �Ա���ֽI����ֽII������˵�������Ũ�Ȼ���Ӱ��H+��OH-��Ǩ��
D. ��ֽI������˵�����˻�����H+��Ǩ�����ʱ�OH-��