题目内容
【题目】铜及其化合物在工农业生产及日常生活中应用非常广泛。
(1) 由辉铜矿制取铜的反应过程为:
2Cu2S(s)+ 3O2(g)==2Cu2O(s)+2SO2(g) △H =-768.2kJ·mol-1,
2Cu2O(s)+Cu2S(s)=6Cu(s)+ SO2(g) △H =+116.0kJ·mol-1,
热化学方程式: Cu2S(s)+ O2(g)==2Cu(s)+2SO2(g) △H =______kJ·mol-1
(2) 氢化亚铜是一种红色固体,可由下列反应制备:4CuSO4+3H3PO2+6H2O==4CuH ↓+4H2SO4+3H3PO4。
①该反应还原剂是___________(写化学式)。
②该反应每转移6mol电子,生成CuH的物质的量为_____。
(3)采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示。
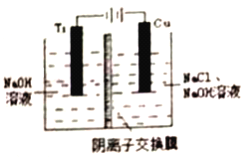
①该电池的阳极生成Cu2O反应式为___________________________。
②钛(Ti) 极附近的pH值_________(填“增大”、“减小”或“不变”)
【答案】 -217.4 H3PO2 2 mol 2Cu-2e-+2OH-=Cu2O+H2O 增大
【解析】(1)①2Cu2S(s)+3O2(g)═2Cu2O(s)+2SO2(g)△H=-768.2kJmol-1,②2Cu2O(s)+Cu2S(s)═6Cu(s)+SO2(g)△H=+116.0kJmol-1,据盖斯定律(①+②)×![]() 得:Cu2S(s)+O2(g)═2Cu(s)+SO2(g)△H=-217.4kJ/mol,故答案为:-217.4;
得:Cu2S(s)+O2(g)═2Cu(s)+SO2(g)△H=-217.4kJ/mol,故答案为:-217.4;
(2)①从反应4CuSO4+3H3PO2+6H2O=4CuH↓+4H2SO4+3H3PO4分析,Cu从+2价变成+1,H从+1价变成-1价,P从+1价变成+5价,还原剂化合价升高,故该反应的还原剂是H3PO2,故答案为:H3PO2;
②Cu从+2价变成+1,4molCu得到4mol电子,H从+1价变成-1价,4mol-1价的H得到8mol电子,共得电子12mol,即每生成4molCuH转移电子12mol,所以每转移6mol电子,生成CuH的物质的量为2mol,故答案为:2mol;
(3)①在电解池中,当阳极是活泼电极时,该电机本身发生失电子得还原反应,在碱性环境下,金属铜失去电子的电极反应为2Cu-2e-+2OH-=Cu2O+H2O,故答案为:2Cu-2e-+2OH-=Cu2O+H2O;
②钛极是阴极发生氢离子得电子的还原反应,所以消耗氢离子,则pH值增大,故答案为:增大。

【题目】I.有机物的结构可用“键线式”简化表示.CH3-CH=CH-CH3可简写为![]() .有机物X的键线式为:
.有机物X的键线式为: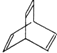
(1)有机物Y是X的同分异构体,且属于芳香烃,写出Y的结构简式_______________;
(2)Y在一定条件下发生聚合反应,写出其反应的化学方程式_______________________;
(3)二甲苯苯环上的一溴代物有6种同分异构体,这些一溴代物与生成它们的对应二甲苯的熔点分别为:
一溴代二甲苯 | 234℃ | 206℃ | 213.8℃ | 204℃ | 214.5℃ | 205℃ |
对应二甲苯 | 13℃ | -54℃ | -27℃ | -54℃ | -27℃ | -54℃ |
由以上数据推断:
熔点为234℃的一溴代二甲苯的结构简式为____________;熔点为-27℃的二甲苯的名称为____________;
II.治疗甲型H1N1流感的常见药物有奥司他韦、扎那米韦、金刚乙胺及金刚烷胺以及预防药物如中药材金银花、大青叶等。其中金刚烷胺可按下列路线合成:

已知狄尔斯阿德耳反应(也称双烯合成反应)如下所示:

试回答下列问题:
(1)B的结构式为________________(填键线式)。
(2)上述物质中,属于同分异构体的是________(填字母)。
(3)上述反应中,属于加成反应的是________(填数字)。