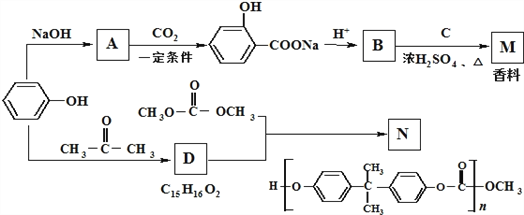
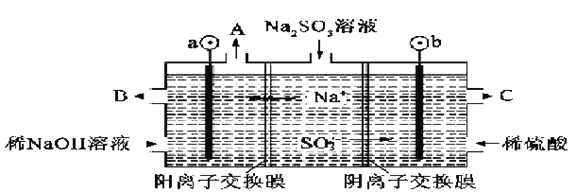
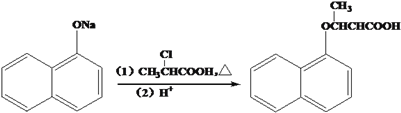题目内容
【题目】I.某烧碱样品含有少量不与酸作用的杂质,为了测定其纯度,进行以下操作:
A.在250 mL的容量瓶中准确配制250 mL烧碱溶液
B.用碱式滴定管移取25 mL烧碱溶液于锥形瓶中并滴入2滴甲基橙指示剂
C.在天平上准确称取烧碱样品m g,在烧杯中用蒸馏水溶解
D.将浓度为c mol·L-1的标准硫酸装入酸式滴定管,调整液面记下开始读数V1
E.在锥形瓶下垫一张白纸,滴定至橙色为止,记下读数V2
就此实验完成下列填空:
(1)正确的操作步骤的顺序是(用编号字母填写):________________。
(2)下列操作中可能使所测NaOH的质量分数偏低的是__________。
a.滴定操作中,锥形瓶残留少量蒸馏水
b.B步操作中,装入烧碱溶液之前未用待测液润洗
c.D步操作中酸式滴定管在装入标准H2SO4溶液前未用标准液润洗
d.读取硫酸体积时,开始时仰视读数,结束时俯视读数
(3)该烧碱样品纯度的计算式为______________________。
II.以下是FeSO4·7H2O的实验窒制备流理图。

根据题意完成下列填空:
(1)反应1需要加热数分钟,其原因是 ;操作A为 。
(2)测定FeSO4·7H2O产品中Fe2+含量的常用方法是KMnO4溶液滴定法。已知称取3.0g FeSO4·7H2O产品,配制成溶液,用硫酸酸化的0.01moL·L-1 KMnO4溶液滴定,消耗KMnO4溶液的体积为200.00mL。KMnO4溶液应盛装在 滴定管中,发生反应的离子方程式为 ,计算上述样品中FeSO4·7H2O的质量分数为 (保留两位有效数字)。[
【答案】
Ⅰ.(1)CABDE; (2)bd; (3)![]() ×100%;
×100%;
Ⅱ.(1)促进Na2CO3水解,溶液的碱性增强,去污能力增强;过滤
(2)酸式;MnO4-+5Fe2++8H+=Mn2++5Fe3++4H20;93%;
【解析】
试题分析:Ⅰ.(1)在天平上准确称取烧碱样品Wg,在烧杯中用蒸馏水溶解,在250mL的容量瓶中配制250mL烧碱溶液,用移液管移取25mL烧碱溶液于锥形瓶中并滴加几滴酚酞做指示剂,将物质的量浓度为c的标准硫酸溶液装入酸式滴定管.调整液面记下开始读数为V1mL,在锥形瓶下垫一张白纸,滴定至红色刚好消失为止,记下读数V2mL,故正确的操作顺序为:C→A→B→D→E,故答案为:C、A、B、D、E;
(2)a.滴定操作中,锥形瓶残留少量蒸馏水,对实验结果无影响,错误;b.B步操作中,装入烧碱溶液之前未用待测液润洗,导致氢氧化钠溶液的浓度偏低,结果偏低,正确;c.D步操作中酸式滴定管在装入标准H2SO4溶液前未用标准液润洗,导致硫酸浓度偏小,消耗硫酸的体积偏大,结果偏高,错误;d.读取硫酸体积时,开始时仰视读数,结束时俯视读数,导致硫酸的体积偏小,结果偏低,正确;故选bd;
(3)滴到消耗的硫酸为:n(硫酸)=cV=(V2-V1)×10-3L×cmol/L,根据反应方程可知,n(NaOH)=2n(硫酸)=2c(V2-V1)×10-3mol,所以原来样品中氢氧化钠的物质的量为:2c(V2-V1) × 10-3mol × ![]() = 2c(V2-V1) × 10-2mol,则样品中氢氧化钠的质量为m(NaOH)=nM=80c(V2-V1)×10-2g,则该烧碱样品的纯度为:
= 2c(V2-V1) × 10-2mol,则样品中氢氧化钠的质量为m(NaOH)=nM=80c(V2-V1)×10-2g,则该烧碱样品的纯度为:![]() ×100%=
×100%=![]() ×100%;故答案为:
×100%;故答案为:![]() ×100%;
×100%;
II.(1)反应1需要加热数分钟,可以促进Na2CO3水解,溶液的碱性增强,去污能力增强;分离固体和液体通常用过滤的方法,过滤所得固体表面有可溶性杂质,通过洗涤除去,所以操作A为过滤,故答案为:促进Na2CO3水解,溶液的碱性增强,去污能力增强;过滤;
(2)酸性高锰酸钾溶液具有强氧化性,应该选用酸式滴定管盛放,酸性高锰酸钾溶液能将亚铁离子氧化成铁离子,反应的离子方程式为5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,根据电子得失守恒有
5 FeSO47H2O~KMnO4,
5×278g 1mol
m(FeSO47H2O) 0.2000mol/L×0.02L
所以(FeSO47H2O)=0.2000mol/L×0.02L×278g=5.56g,所以样品中FeSO47H2O的质量分数为![]() × 100% = 93%,故答案为:酸式;5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;93%。
× 100% = 93%,故答案为:酸式;5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;93%。

 阅读快车系列答案
阅读快车系列答案