题目内容
【题目】化学反应原理揭示了不同的物质在水溶液中有不同的行为。请按要求回答下列问题:(已知:H2SO3: Ka1=1.7×10-2,Ka2=6.0×10-8 ; NH3·H2O:Kb=1.8×10-5)
(1)将等物质的量的SO2与NH3溶于水充分反应,所得溶液呈_________性,该溶液中各离子浓度由大到小的顺序为:_______________,所得溶液中c(H+)-c(OH-)=_______________(填写表达式)
(2)用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示(电极材料为石墨)。
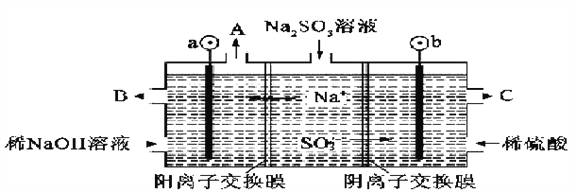
①图中a极要连接电源的(填“正”或“负”)________极;C口流出的物质是________。
②![]() 放电的电极反应式为_______________。
放电的电极反应式为_______________。
【答案】酸c(NH4+)>c(HSO3-)>c(H+)>c(SO32--)>c(OH-)c(HSO3-) + 2c(SO32-) -c(NH4+) 或 c(SO32-) + c(NH3·H2O) - c(H2SO3)负硫酸SO32--2e- + H2O = SO42-+ 2H+
【解析】
(1)若将等物质的量的SO2与NH3溶于水充分反应,恰好生成NH4HSO3,溶液中存在NH4+、HSO3-的电离及HSO3-的水解,且HSO3-的电离大于HSO3-的水解,所得溶液呈酸性,c(OH-)<c(H+);该溶液中各离子浓度由大到小的顺序为 c(NH4+)>c(HSO3-)>c(H+)>c(SO32--)>c(OH-) ;电解质溶液中存在电荷守恒c(H+)+c(NH4+)=c(OH-)+c(HSO3-)+2c(SO32-)得到:c(H+)-c(OH-)=c(HSO3-)+2c(SO32-)-c(NH4+);
(2)图中可知,钠离子移向a极,亚硫酸根离子移向b极,所以b极为阳极,应该接电源的正极,SO32-在阳极失去电子变成SO42-,所以C口流出的物质是H2SO4;
(3)亚硫酸根离子在阳极失去电子发生氧化反应生成硫酸根离子,电极反应式为:SO32--2e-+H2O=SO42-+2H+。