题目内容
【题目】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。
I.已知H2A在水中存在以下平衡:H2A![]() H++HA-,HA-
H++HA-,HA-![]() H++A2-。
H++A2-。
⑴NaHA溶液__________(选填“显酸性”、“显碱性”、“显中性”或“无法确定”)。
⑵某温度下,0.1 mol/L的NaHA溶液,下列关系中,一定正确的是___________。
A.c(H+)·c(OH-)=1×10―14
B.c(Na+)+c(H+)=c(HA-)+2c(A2-)
C.c(Na+)>c(HA-)>c(A2-)>c(H2A)
D.c(Na+)=c(HA-)+c(A2-)+c(H2A)
⑶已知常温下,H2A的钙盐(CaA)饱和溶液中存在以下平衡:
CaA(s)![]() Ca2+(aq)+A2-(aq) △H>0。
Ca2+(aq)+A2-(aq) △H>0。
①降低温度时,Ksp_______(填“增大”、“减小”或“不变”,下同)。
②滴加少量浓盐酸,c(Ca2+)__________。
③测得25℃时,CaA的Ksp为2.0×10-11,常温下将10 g CaA固体投入100 mL CaCl2溶液中,充分搅拌后仍有固体剩余,测得溶液中c(Ca2+)=0.1 mol/L,则溶液中c(A2-)= _________mol/L
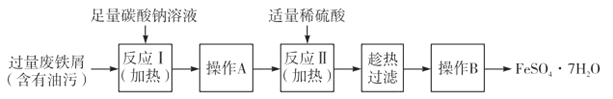
II.工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有还原沉淀法,该法的工艺流程为:
CrO42-![]() Cr2O72-
Cr2O72-![]() Cr3+
Cr3+![]() Cr(OH)3
Cr(OH)3
其中第①步存在平衡:2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显 色.
(2)第②步中,还原1mol Cr2O72-离子,需要________mol的FeSO4·7H2O。
(3)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s)![]() Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至 。
【答案】
Ⅰ.(1)无法确定;(2)D
(3)①减小;②增大;③2.0×10-10;
Ⅱ.(1)橙色;(2)6mol;(3)5;
【解析】
试题分析:I.⑴NaHA溶液中存在HA-的电离和水解平衡,大小程度无法判断,因此溶液的酸碱性无法确定,故答案为:无法确定;
⑵A.温度未知,c(H+)·c(OH-)不一定等于1×10―14,错误;B.根据电荷守恒,c(Na+)+c(H+)=c(HA-)+2c(A2-)+ c(OH-),错误;C.HA-的电离和水解程度大小无法判断, c(HA-) 与c(A2-)的大小无法判断,错误;D.根据物料守恒,c(Na+)=c(HA-)+ c(A2-)+ c(H2A),正确;故选D;
⑶①降低温度时,溶解度减小,Ksp减小,故答案为:减小;
②滴加少量浓盐酸,c(A2-)减小,平衡右移,c(Ca2+)增大,故答案为:增大;
③已知溶液中c(Ca2+)=0.1mol/L,Ksp=c(Ca2+)×c(A2+)=2.0×10-11,则c(A2-)=![]() mol/L=2.0×10-10mol/L,故答案为:2.0×10-10;
mol/L=2.0×10-10mol/L,故答案为:2.0×10-10;
Ⅱ.(1)c(H+)增大,平衡2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O右移,溶液呈橙色,故答案为:橙;
Cr2O72-(橙色)+H2O右移,溶液呈橙色,故答案为:橙;
(2)根据电子得失守恒:n(Cr2O72-)×6=n(FeSO47H2O)×1,n(FeSO47H2O)=![]() =6mol,故答案为:6;
=6mol,故答案为:6;
(3)当c(Cr3+)=10-5mol/L时,溶液的c(OH-)=![]() =10-9 mol/L,c(H+)═
=10-9 mol/L,c(H+)═![]() =10-5mol/L,pH=5,即要使c(Cr3+)降至10-5mol/L,溶液的pH应调至5,故答案为:5。
=10-5mol/L,pH=5,即要使c(Cr3+)降至10-5mol/L,溶液的pH应调至5,故答案为:5。