题目内容
9.已知A、B、C、D、E、F、G都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素.A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子,G的+1价阳离子正好充满K、L、M三个电子层.回答下列问题:(1)A、B、C、D、E、F、G几种元素中第一电离能最小的是K (填元素符号),D元素的原子核外有17种不同运动状态的电子,有5种不同能级的电子,基态的F3+核外电子排布式是1s22s22p63s23p63d5.
(2)B的气态氢化物在水中的溶解度远大于A、C的气态氢化物,原因是NH3与H2O分子间存在氢键,CH4、H2S分子与H2O分子间不存在氢键.
(3)化合物AC2的电子式是
 .
.(4)FD3与ECAB溶液混合,得到含多种配合物的血红色溶液,其中配位数为5的配合物的化学式是K2Fe(SCN)5.
(5)化合物EF[F(AB)6]是一种蓝色晶体,如图1表示其晶胞的$\frac{1}{8}$(E+未画出).该蓝色晶体的一个晶胞中E+的个数为4.
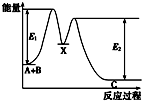
(6)G的二价阳离子能与乙二胺(H2N-CH2一CH2一NH2)形成配离子(如图2):该配离子中含有的化学键类型有abd.(填字母)
a.配位键 b.极性键 c.离子键 d.非极性键
阴离子CAB-中的A原子与乙二胺(H2N-CH2一CH2一NH2)中C原子的杂化方式分别为sp和sp3.
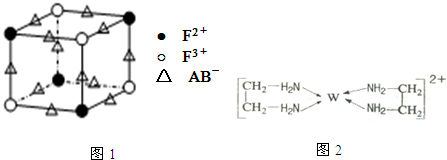
分析 A、B、C、D、E、F、G都是周期表中前四周期的元素,它们的核电荷数依次增大,A、B、C、D、E为不同主族的元素,A、C的最外层电子数都是其电子层数的2倍,A为C、C为S元素;
透过蓝色钴玻璃观察E的焰色反应为紫色,则E为K元素,D原子序数大于C而小于E为主族元素,则D是Cl元素;
B的电负性大于C,且原子序数小于C,且主族元素处于不同主族,则B为N元素;
F的基态原子中有4个未成对电子,且位于第四周期元素,则F为Fe元素;G的+1价阳离子正好充满K、L、M三个电子层,则G为Cu元素;
结合题目分析解答.
解答 解:A、B、C、D、E、F、G都是周期表中前四周期的元素,它们的核电荷数依次增大,A、B、C、D、E为不同主族的元素,A、C的最外层电子数都是其电子层数的2倍,A为C、C为S元素;
透过蓝色钴玻璃观察E的焰色反应为紫色,则E为K元素,D原子序数大于C而小于E为主族元素,则D是Cl元素;
B的电负性大于C,且原子序数小于C,且主族元素处于不同主族,则B为N元素;
F的基态原子中有4个未成对电子,且位于第四周期元素,则F为Fe元素;G的+1价阳离子正好充满K、L、M三个电子层,则G为Cu元素;
(1)元素的金属性越强,其第一电离能越小,这几种元素中金属性最强的是K,则第一电离能最小的是K;
D是Cl元素,原子核外有多少个电子,电子就有多少种运动状态,所以Cl元素原子核外电子有17种运动状态,有5种不同的能级;F是Fe元素,失去三个电子生成铁离子,铁离子核外有23个电子,根据构造原理知铁离子核外电子排布式为1s22s22p63s23p63d5,
故答案为:K;17;5;1s22s22p63s23p63d5;
(2)B的氢化物是氨气、C的氢化物是硫化氢、A的氢化物是甲烷,硫化氢、甲烷和水分子不能形成氢键、氨气和水分子能形成氢键,氢键的存在促进其溶解度增大,所以氨气的溶解度大于甲烷和硫化氢,
故答案为:NH3与H2O分子间存在氢键,CH4、H2S分子与H2O分子间不存在氢键;
(3)化合物CS2的电子式为 ,故答案为:
,故答案为: ;
;
(4)FeCl3与KSCN溶液混合得到含多种配合物的血红色溶液,生成的配合物为铁氰化钾,其中配位数为5的配合物的化学式是K2Fe(SCN)5,故答案为:K2Fe(SCN)5;
(5)化合物KFe[Fe(CN)6]是一种蓝色晶体,如图1表示其晶胞的$\frac{1}{8}$(E+未画出),该晶胞中Fe2+个数=$\frac{1}{8}×4×8$=4,Fe3+个数=$\frac{1}{8}×4×8$=4,CN-个数=12×$\frac{1}{4}$×8=24,根据化合物中各元素化合价的代数和为0知,K+个数=$\frac{24×1-4×2-4×3}{1}$=4,故答案为:4;
(6)Cu的二价阳离子能与乙二胺(H2N-CH2一CH2一NH2)形成配离子(如图2),C-C原子之间存在非极性键、C-N和C-H及N-H原子之间存在极性键,铜离子和氮原子之间存在配位键,所以该配离子中含有的化学键类型有配位键、极性键、非极性键,故选abd;
SCN-中的C原价层电子对个数是2且不含孤电子对,所以C原子杂化方式为sp,乙二胺(H2N-CH2一CH2一NH2)中C原子价层电子对个数是4且不含孤电子对,所以C的杂化方式为sp3,
故答案为:abd;sp;sp3.
点评 本题考查位置结构性质的相互关系及应用,涉及晶胞计算、原子杂化方式判断、配合物、氢键等知识点,侧重考查学生分析应用能力,这些都是高考高频点,注意图1不是一个晶胞,为易错点.

 反应A+B→C分两步进行:①A+B→X,②X→C,反应过程中能量变化如图所示,E4表示反应A+B→X的活化能,下列有关叙述正确的是( )
反应A+B→C分两步进行:①A+B→X,②X→C,反应过程中能量变化如图所示,E4表示反应A+B→X的活化能,下列有关叙述正确的是( )| A. | Ee表示反应X→C的活化能 | |
| B. | X是反应A+B→C的催化剂 | |
| C. | 反应A+B→C的△H<0 | |
| D. | 加入催化剂可改变反应A+B→C的焓变 |
| A. | 水很稳定(1000℃以上才会部分分解)是因为水中含有大量的氢键所致 | |
| B. | 乳酸(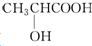 )有一对手性异构体,因为其分子中含有一个手性碳原子 )有一对手性异构体,因为其分子中含有一个手性碳原子 | |
| C. | 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释 | |
| D. | 酸性:H3PO4>HClO,因为H3PO4的非羟基氧原子数比HClO的多 |
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向某溶液中加入盐酸酸化的BaCl2溶液 | 生成白色沉淀 | 该溶液中一定含有SO42- |
| B | 将少量的溴水滴入FeCl2、NaI的混合溶液中, 再滴加CCl4,振荡、静置,向上层溶液中滴 加KSCN溶液.再向上层溶液中滴加溴水 | 实验现象1: 上层溶液不变红, 下层溶液紫红色 实验现象2: 上层溶液变红 | 氧化性: Br2>Fe3+>I2 |
| C | 取久置的Na2O2粉末,向其中滴加过量的盐酸 | 产生无色气体 | Na2O2没有变质 |
| D | 浓度相同的ZnCl2、CuCl2溶液中,滴入少量Na2S溶液 | 只有黑色沉淀 | Ksp(CuS)>Ksp(ZnS) |
| A. | A | B. | B | C. | C | D. | D |
| A. | 对于乙酸与乙醇的酯化反应(△H<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大 | |
| B. | 乳酸薄荷醇酯(如图 )能发生水解、氧化、消去反应、以及与氢气的加成反应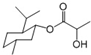 | |
| C. | 0.1mol丙烯酸中含有双键的数目为0.1NA | |
| D. | 乙醛和丙烯醛(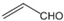 )不是同系物,它们与氢气充分反应后的产物是同系物 )不是同系物,它们与氢气充分反应后的产物是同系物 |
| A. | 激素类药物乙烯雌酚的结构简式为: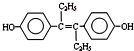 ,它的分子式是:C18H20O2 ,它的分子式是:C18H20O2 | |
| B. | 等质量的甲烷、乙烯、乙醇分别充分燃烧,所耗用氧气的量依次减少 | |
| C. | 聚乳酸(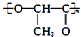 )是由单体之间通过加聚反应合成的 )是由单体之间通过加聚反应合成的 | |
| D. | 实验证实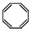 可使溴的四氯化碳溶液褪色,说明该分子中存在碳碳双键. 可使溴的四氯化碳溶液褪色,说明该分子中存在碳碳双键. |
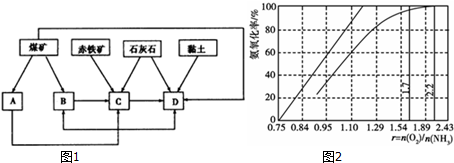
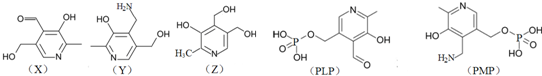
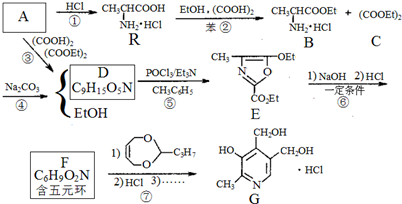
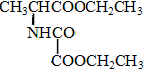 、F
、F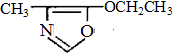 .
.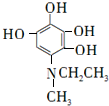 等.
等. .
.