题目内容
18.下列说法正确的是( )| A. | 对于乙酸与乙醇的酯化反应(△H<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大 | |
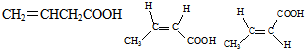
| B. | 乳酸薄荷醇酯(如图 )能发生水解、氧化、消去反应、以及与氢气的加成反应 | |
| C. | 0.1mol丙烯酸中含有双键的数目为0.1NA | |
| D. | 乙醛和丙烯醛( )不是同系物,它们与氢气充分反应后的产物是同系物 )不是同系物,它们与氢气充分反应后的产物是同系物 |
分析 A、该反应放热,加热平衡逆向移动;
B、乳酸薄荷醇酯中含有羟基和酯基,据官能团具有的性质分析;
C、丙烯酸中有碳碳双键和碳氧双键;
D、乙醛是饱和一元醛,丙烯醛是不饱和一元醛,催化加氢后都生成饱和一元醛.
解答 解:A、加热平衡逆向移动,平衡常数减小,故A错误;
B、乳酸薄荷醇酯中含有羟基和酯基,能发生水解、氧化、消去反应但不能与氢气加成,故B错误;
C、0.1mol丙烯酸中含有双键的数目为0.2NA,故C错误;
D、乙醛是饱和一元醛,丙烯醛是不饱和一元醛,催化加氢后都生成饱和一元醛,是同系物,故D正确;
故选D.
点评 本题考查了平衡移动、官能团的性质、同系物的判断,题目难度不大.

练习册系列答案
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案
相关题目
8.如图是部分短周期主族元素原子半径与原子序数的关系图.下列说法错误的是( )
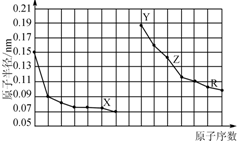

| A. | X、R的最高化合价相同 | |
| B. | 简单离子的半径:X>Y>Z | |
| C. | Y、Z、R对应的最高价氧化物的水化物相互之间可以发生反应 | |
| D. | 电解熔融的X与Z构成的化合物可以得到单质Z |
13.如表为元素周期表中短周期的一部分,四种元素中只有一种是金属,下列说法错误的是( )
| Q | R | ||
| T | W | ||
| A. | 气态氢化物稳定性:R>Q | |
| B. | 元素T的离子结构示意图为 | |
| C. | 与W同主族的某元素形成的18电子的氢化物分子中既有极性键又有非极性键 | |
| D. | W可形成多种含氧酸 |
3.实验室用锌粒与20ml浓度为2mol/L的稀硫酸反应制取氢气,若向反应混合物中加入下列物质,下列关于化学反应速率说法正确的是( )
| A. | 少量NaNO3固体,v(H2)减小 | B. | 20mL BaCl2溶液,v(H2)不变 | ||
| C. | 少量NaHSO4固体,v(H2)不变 | D. | 改用18mol/L的硫酸,v(H2)增大 |
10.现有8种元素的性质、数据如表所列,它们属于第二或第三周期.
回答下列问题:
(1)③的元素符号是Li,⑧的最高价氧化物对应水化物是Al(OH)3.
①在元素周期表中的位置是(周期、族)第二周期ⅥA族.
(2)碱性最强的化合物的电子式是: ;属离子化合物(填“离子”或“共价”).
;属离子化合物(填“离子”或“共价”).
(3)比较④和⑦的氢化物的稳定性(用化学式表示)NH3>PH3.
(4)写出⑦的最高价氧化物对应水化物跟它的氢化物反应的化学方程式:NH3+HNO3=NH4NO3.
(5)写出②最高价氧化物对应水化物跟⑤的氢化物水溶液反应的离子方程式:Mg(OH)2+2H+=Mg2++2H2O.
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 1.43 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
(1)③的元素符号是Li,⑧的最高价氧化物对应水化物是Al(OH)3.
①在元素周期表中的位置是(周期、族)第二周期ⅥA族.
(2)碱性最强的化合物的电子式是:
 ;属离子化合物(填“离子”或“共价”).
;属离子化合物(填“离子”或“共价”).(3)比较④和⑦的氢化物的稳定性(用化学式表示)NH3>PH3.
(4)写出⑦的最高价氧化物对应水化物跟它的氢化物反应的化学方程式:NH3+HNO3=NH4NO3.
(5)写出②最高价氧化物对应水化物跟⑤的氢化物水溶液反应的离子方程式:Mg(OH)2+2H+=Mg2++2H2O.
7.下列有关物质的性质与应用的叙述都正确的是( )
| A. | 明矾溶液具有强氧化性,可用作净水剂 | |
| B. | 二氧化硅不与任何酸反应,可用石英制造耐酸容器 | |
| C. | 铜的金属活动性比铁弱,可在海轮外壳上装若干铜块以减缓其腐蚀 | |
| D. | 常温下,铝能被浓硝酸钝化,可用铝制槽车运送浓硝酸 |
 .
.





 .
.