题目内容
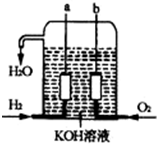
15.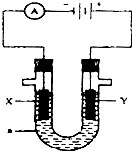 如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:(1)若X、Y都是惰电极,α是ΝαΟΗ溶液,
①电解池中X极上的电极反应式为2H++2e-=H2↑
②总的电解化学方程式为2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑
③电解后溶液PH的变化为变大(变大、不变或变小)
(2)若X、Y都是惰?电极,α是Η2SO4是溶液,
①电解池中Y电极上的电极反应式为4OH--4e-=2H2O+O2↑
②电解后溶液PH的变化为变小(变大、不变或 变小)
(3)如要用电解方法精练粗铜,电解液α选用ΧυΣΟ4溶液,则
①X电极的材料是精铜,
②Y电极的材料是粗铜,电极反应式为Cu-2e-=Cu2+.(说明:杂质发生的电极反应不必写出)?
分析 (1)电解ΝαΟΗ溶液时,阳极上是氢氧根离子失电子,阴极上是氢离子得电子,电解化学方程式为电解水;
(2)电解Η2SO4溶液时,阳极上是氢氧根离子失电子,阴极上是氢离子得电子,电解化学方程式为电解水;
(3)电解方法精炼粗铜,电解液a选用CuSO4溶液,粗铜做阳极,精铜做阴极.
解答 解:(1)电解ΝαΟΗ溶液时,与正极相连的Y极阳极上是氢氧根离子失电子,与负极相连的X极阴极上是氢离子得电子,反应式为:2H++2e-=H2↑,电解化学方程式为电解水,反应式为:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,所以电解后溶液浓度增大,碱性增强,则pH变大,
故答案为:①2H++2e-=H2↑,②2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,③变大;
(2)电解Η2SO4溶液时,与正极相连的Y极阳极上是氢氧根离子失电子,反应式为:4OH--4e-=2H2O+O2↑,阴极上是氢离子得电子,电解化学方程式为电解水,反应式为:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,所以电解后溶液浓度增大,酸性增强,则pH变小,故答案为:①4OH--4e-=2H2O+O2↑,②变小;
(3)电解方法精炼粗铜,电解液a选用CuSO4溶液,粗铜做阳极,精铜做阴极,所以与正极相连的Y极阳极为粗铜,反应式为:Cu-2e-=Cu2+,与负极相连的X极阴极为精铜,故答案为:①精铜,②粗铜,Cu-2e-=Cu2+.
点评 本题考查了电解原理的分析应用,主要是电极反应和电极判断,电子守恒是金属的依据,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
6.下列有关叙述不正确的是( )
| A. | 由于Al2O3熔点比Al高,所以在酒精灯上加热铝箔时,铝熔化但不滴落 | |
| B. | 铁丝不论在空气中还是纯氧中都不会燃烧 | |
| C. | 钠与氧气反应时,产物是由反应条件决定 | |
| D. | 金属单质与非金属单质发生反应时,被氧化的一定是金属单质 |
10.用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 10g 46%的乙醇溶液所含氢原子数为1.2NA | |
| B. | 0.5 mol熔融的NaHSO4中含有的离子数目为1.5NA | |
| C. | 标准状况下,2.24L甲醇中含有C-H键的数目为0.3NA | |
| D. | S2和S8的混合物共38.4g,其中所含硫原子数为1.4NA |
20.电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图,下列说法不正确的是( )


| A. | O2在电极b上发生还原反应 | |
| B. | 溶液中OH-向电极b移动 | |
| C. | 反应消耗的NH3与O2的物质的量之比为4:3 | |
| D. | 负极的电极反应式为:2NH3-6e-+6OH-═N2+6H2O |
5.取一定质量的Cu2O与CuO的固体混合物.将其分成两等份.向其中一份通入足量的氢气,充分反应后固体质量为25.6g,另一份加入500mL稀硝酸中,固体恰好完全溶解并产生标准状态下的NO气体4.48L.已知Cu2O+2H+═Cu+Cu2++H2O.则稀硝酸的浓度为( )
| A. | 2mol•L-1 | B. | 1.6mol•L-1 | C. | 0.8mol•L-1 | D. | 0.4mol•L-1 |
 美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电池,其构造如图所示;两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电.
美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电池,其构造如图所示;两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电.