题目内容
5.取一定质量的Cu2O与CuO的固体混合物.将其分成两等份.向其中一份通入足量的氢气,充分反应后固体质量为25.6g,另一份加入500mL稀硝酸中,固体恰好完全溶解并产生标准状态下的NO气体4.48L.已知Cu2O+2H+═Cu+Cu2++H2O.则稀硝酸的浓度为( )| A. | 2mol•L-1 | B. | 1.6mol•L-1 | C. | 0.8mol•L-1 | D. | 0.4mol•L-1 |
分析 一份用足量的氢气还原,反应后固体质量为Cu的质量,另一份中加入500mL稀硝酸,固体恰好完全溶解,溶液中溶质为Cu(NO3)2,根据Cu元素守恒可知:n[Cu(NO3)2]=n(Cu),根据氮元素守恒可知n(HNO3)=n(NO)+2n[Cu(NO3)2],再根据c=$\frac{n}{V}$计算硝酸的浓度.
解答 解:一份用足量的氢气还原,反应后固体质量为Cu的质量,故n(Cu)=$\frac{25.6g}{64g/mol}$=0.4mol,
另一份中加入500mL稀硝酸,固体恰好完全溶解,溶液中溶质为Cu(NO3)2,根据Cu元素守恒可知:n[Cu(NO3)2]=n(Cu)=0.4mol,根据氮元素守恒可知:n(HNO3)=n(NO)+2n[Cu(NO3)2]=$\frac{4.48L}{22.4L/mol}$+2×0.4mol=1mol,故c(HNO3)=$\frac{1mol}{0.5L}$=2mol/L,
故选:A.
点评 本题考查混合物的计算,清楚反应过程是解题的关键,注意利用守恒法进行解答,侧重考查学生分析计算能力,难度中等.

练习册系列答案
相关题目
13.干燥的HCl 气体具有的性质是( )
| A. | 使干燥的蓝色石蕊试纸变红 | B. | 具有漂白性 | ||
| C. | 使含碱的红色酚酞试液褪色 | D. | 能与锌反应放出氢气 |
17.在水溶液中既能被氧化,又能发生水解的离子是( )
| A. | Cl- | B. | I- | C. | Al3+ | D. | Fe2+ |
15.某元素X有质量数分别为b和c的两种稳定的同位素,X元素的近似相对原子质量为a,则质量数分别为b和c的两种同位素的原子个数比为( )
| A. | $\frac{a-c}{b-a}$ | B. | $\frac{a-c}{b-c}$ | C. | $\frac{a-b}{a-c}$ | D. | $\frac{b-c}{a-c}$ |
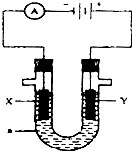 如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: