题目内容
6.下列有关叙述不正确的是( )| A. | 由于Al2O3熔点比Al高,所以在酒精灯上加热铝箔时,铝熔化但不滴落 | |
| B. | 铁丝不论在空气中还是纯氧中都不会燃烧 | |
| C. | 钠与氧气反应时,产物是由反应条件决定 | |
| D. | 金属单质与非金属单质发生反应时,被氧化的一定是金属单质 |
分析 A、铝与氧气反应生成氧化铝的熔点高;
B、铁在纯氧中燃烧生成四氧化三铁;
C、氧气和钠反应,没有条件时生成氧化钠,燃烧时生成过氧化钠;
D、金属原子结构可知金属单质一定失电子被氧化;
解答 A、铝与氧气反应生成氧化铝的熔点高,则铝箔在酒精灯火焰上加热熔化但不滴落,Al2O3熔点一定高于Al单质,故A正确;
B、铁在在空气中不能燃烧,在纯氧中燃烧生成四氧化三铁,故B错误;
C、氧气和钠反应的方程式为2Na+O2$\frac{\underline{\;\;△\;\;}}{\;}$Na2O2、4Na+O2=2Na2O,所以反应条件不同产物不同,故C正确;
D、金属原子结构可知金属单质一定失电子被氧化,金属与非金属发生反应时,被氧化的一定是金属,故D正确;
故选B.
点评 本题考查了金属性质的分析,主要是反应条件、反应用量的分析判断,掌握基础是关键,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17.下列物质的水溶液能导电,但属于非电解质的是( )
| A. | HNO3 | B. | Cl2 | C. | SO2 | D. | NH4NO3 |
14.在带有活塞的密闭容器中发生反应:Fe2O3(s)+3H2(g)═2Fe(s)+3H2O(g),采取下列措施能改变反应速率的是( )
| A. | 增加Fe2O3的量 | B. | 增加Fe的量 | ||
| C. | 充入N2,保持容器内压强不变 | D. | 充入N2,保持容器内体积不变 |
1.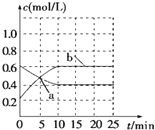 2NO2(g)?N2O4(g)△H<0.现将NO2和N2O4混合气体通入恒温密闭容器中,反应中物质浓度随时间的变化如图.下列说法正确的是( )
2NO2(g)?N2O4(g)△H<0.现将NO2和N2O4混合气体通入恒温密闭容器中,反应中物质浓度随时间的变化如图.下列说法正确的是( )
 2NO2(g)?N2O4(g)△H<0.现将NO2和N2O4混合气体通入恒温密闭容器中,反应中物质浓度随时间的变化如图.下列说法正确的是( )
2NO2(g)?N2O4(g)△H<0.现将NO2和N2O4混合气体通入恒温密闭容器中,反应中物质浓度随时间的变化如图.下列说法正确的是( )| A. | a点表示反应处于平衡状态 | |
| B. | 25 min末,若增大压强,化学平衡常数增大 | |
| C. | 25 min末,若升高温度,NO2的体积分数减小 | |
| D. | 10min内用N2O4表示的平均速率为0.02mol•L-1•min-1 |
11.检验溶液中是否含有某种离子,下列操作方法正确的是( )
| A. | 加入AgNO3溶液,有白色沉淀生成,证明有Cl- | |
| B. | 用硝酸酸化后取上层清液,加入Ba(OH)2溶液,析出白色沉淀,证明有SO42- | |
| C. | 加浓NaOH溶液后加热,产生使湿润的红色石蕊试纸变蓝色的气体,证明有NH4+ | |
| D. | 加入盐酸,放出能使澄清石灰水变浑浊的气体,证明含有CO32- |

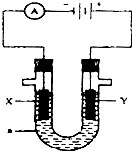 如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: