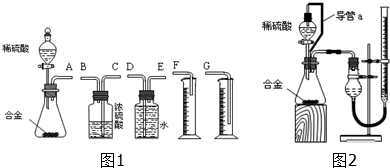
题目内容
10.用NA表示阿伏加德罗常数,下列叙述正确的是( )| A. | 10g 46%的乙醇溶液所含氢原子数为1.2NA | |
| B. | 0.5 mol熔融的NaHSO4中含有的离子数目为1.5NA | |
| C. | 标准状况下,2.24L甲醇中含有C-H键的数目为0.3NA | |
| D. | S2和S8的混合物共38.4g,其中所含硫原子数为1.4NA |
分析 A、分别计算出乙醇和水的物质的量,然后根据1mol乙醇中含6mol氢原子和1mol水中含2mol氢原子来分析;
B、熔融的NaHSO4只能电离为钠离子和HSO4-;
C、标况下,甲醇为液态;
D、S2和S8均由硫原子构成来分析.
解答 解:A、10g46%的乙醇的物质的量为0.1mol,所含氢原子数目为0.6NA;10g46%的乙醇中含水5.4g,物质的量为0.3mol,所含氢原子数为0.6NA,共含有氢原子数 为1.2NA,故A正确;
B、熔融的NaHSO4只能电离为钠离子和HSO4-,故0.5mol熔融的NaHSO4中含1mol离子即NA个,故B错误;
C、标况下,甲醇为液态,不能根据气体摩尔体积来计算,故C错误;
D、S2和S8均由硫原子构成,故38.4g的混合物中含有的硫原子的物质的量n=$\frac{38.4g}{32g/mol}$=1.2mol即1.2NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
20.已知有反应BrO${\;}_{3}^{-}$+5Br-+6H+═3Br2+3H2O.下列反应中从反应原理来看与该反应最相似的是( )
| A. | 2KNO3═2KNO2+O2↑ | B. | NH4HCO3═NH3↑+CO2↑+H2O | ||
| C. | 3NO2+H2O═2HNO3+NO | D. | SO2+2H2S═3S↓+2H2O |
1.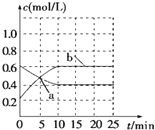 2NO2(g)?N2O4(g)△H<0.现将NO2和N2O4混合气体通入恒温密闭容器中,反应中物质浓度随时间的变化如图.下列说法正确的是( )
2NO2(g)?N2O4(g)△H<0.现将NO2和N2O4混合气体通入恒温密闭容器中,反应中物质浓度随时间的变化如图.下列说法正确的是( )
 2NO2(g)?N2O4(g)△H<0.现将NO2和N2O4混合气体通入恒温密闭容器中,反应中物质浓度随时间的变化如图.下列说法正确的是( )
2NO2(g)?N2O4(g)△H<0.现将NO2和N2O4混合气体通入恒温密闭容器中,反应中物质浓度随时间的变化如图.下列说法正确的是( )| A. | a点表示反应处于平衡状态 | |
| B. | 25 min末,若增大压强,化学平衡常数增大 | |
| C. | 25 min末,若升高温度,NO2的体积分数减小 | |
| D. | 10min内用N2O4表示的平均速率为0.02mol•L-1•min-1 |
5.配制一定体积、一定物质的量浓度的溶液,下列情况对实验结果产生偏高影响的是( )
| A. | 定容时俯视观察液面 | |
| B. | 容量瓶中原有少量蒸馏水 | |
| C. | 溶解所用的烧杯、玻璃棒未洗涤 | |
| D. | 转移溶液时不慎将少量液体洒落在外 |
19.下列叙述中错误的是( )
| A. | 质量相等,密度不等的N2和C2H4两种气体含有的分子数一定相等 | |
| B. | 同温同压下,等体积的H2和He气含有的质子数相等 | |
| C. | 某物质经分析仅含一种元素,此物质可能是纯净物也可能是混合物 | |
| D. | FeCl3溶液呈电中性,Fe(OH)3胶体带有电荷 |
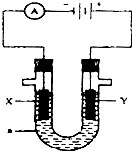 如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: