题目内容
X、Y、Z、R为前四周期元素且原子序数依次增大。X的单质与氢气可以化合生成气体G,其水溶液pH>7;Y单质是一种黄色固体;R是一种应用最广的金属,它的一种含氧酸根化学式为RO42-,且具有强氧化性,在其钠盐中加入稀硫酸,溶液变为黄色,并有无色气体产生。Y、Z分别与钠元素可以形成化合物Q和J,J的水溶液与AgNO3溶液反应可生成不溶于稀硝酸的白色沉淀L;Z与氢元素形成的化合物与G反应生成M。则下列说法不正确的是( )
| A.M是离子化合物,且其溶液中阴阳离子个数比为1:l |
| B.L的悬浊液加入Q的溶液,白色沉淀可以转化为黑色沉淀 |
| C.Na2RO4水溶液可以用于杀菌消毒和净水 |
| D.Q的水溶液中加入铝与Z单质形成的化合物,只有白色沉淀生成 |
A、D
解析试题分析:依题意,可知:X为N,Y为S,Z为Cl,R为Fe,G为NH3,Q为Na2S,J为NaCl,L为AgCl,M为NH4Cl,A、M是离子化合物,但是其中的氨根离子要水解,因此其溶液中阴阳离子个数比小于1:l,错误;B、沉淀之间可以相互转化,正确;C、高铁酸钠中的铁是正六价,具有强的氧化性,可以起到消毒的作用,还原产物三价铁离子可以生成氢氧化铁胶体,从而起到净水的作用,正确;D、Q的水溶液中加入铝与Z单质形成的化合物,除了有白色沉淀生成,还有气体生成,错误。
考点:碘的性质。

练习册系列答案
相关题目
短周期主族元素X、Y、Z、W、Q的原子序数依次增大,X的气态氢化物极易溶于Y的氢化物中,常温下,Z的单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液。下列说法不正确的是
| A.离子半径的大小顺序为Z>W>Q |
| B.元素W的气态氢化物与Y的单质可发生置换反应 |
| C.元素X与Y能在一定条件下发生化合反应,说明Y的非金属性比X强 |
| D.元素Z、W、Q的单质在一定条件下均能和强碱溶液反应 |
下列说法正确的是
A.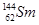 与 与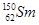 互为同位素 互为同位素 |
| B.氯气能使潮湿的蓝布条变为白色,说明氯气有漂白性 |
| C.将1体积c1mol/L的硫酸用水稀释为5体积,稀溶液的浓度为0.2c1mol/L |
| D.焰色反应一定发生化学变化 |
短周期元素W、X、Y、Z的原子序数依次增大,下列相关比较错误的是
| A.稳定性:H2X H2Z | B.酸性:H2ZO3<H2ZO4 |
| C.还原性:W-<Z2- | D.半径:Y3+<Z2- |
镭是元素周期表中第7周期第IIA族元素,下列有关叙述不正确的是
| A.镭的金属性比钙弱 | B.单质能与水反应生成H2 |
| C.镭在化合物中呈+2价 | D.碳酸镭难溶于水 |
若某原子的外围电子排布式为4d15s2,则下列说法正确的是
| A.该元素在元素周期表中的位置为第五周期IIIB |
| B.该元素位于s区 |
| C.该元素原子为非金属 |
| D.该元素原子N能层共有8个电子 |
前四周期主族非金属元素X、Y、Z和W在元素周期表中的相应位置如图所示。下列说法正确的是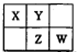
| A.元素X和元素W最高正价代数和一定为8 |
| B.若元素X的原子序数为a,则Z的原子序数一定为a+9 |
| C.常温下,若X的简单氢化物的水溶液能使红色石蕊试液变蓝,则元素Y的简单氢化物的沸点一定高于元素W的简单氢化物 |
| D.原子半径的大小顺序为:rW>rZ>rX>rY |