题目内容
11.下表中的实验操作能达到实验目的或能得出相应结论的是( )| 选项 | 实验操作 | 实验目的或结论 |
| A | 在硅酸钠溶液中滴入稀盐酸,溶液变浑浊. | 非金属性:Cl>Si |
| B | C2H5Br与Br2的溶液混合中加入Na2SO3溶液充分振荡后分液 | 除去C2H5Br中的溴 |
| C | 向某溶液中加氯化钡溶液产生白色沉淀,再加稀硝酸沉淀不消失 | 说明原溶液中一定含有 SO42- |
| D | 向无水乙醇中加入浓H2SO4,加热至170°C产生的气体通入酸性KMnO4溶液,红色褪去 | 证明生成的气体全部是 乙烯 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.元素的非金属性越强,其最高价氧化物的水化物酸性越强;
B.Na2SO3溶液能与Br2发生氧化还原反应生成硫酸钠和溴化钠,且亚硫酸钠碱性小于NaOH;
C.能和氯化钡溶液反应生成不溶于稀硝酸的离子有银离子、钡离子、亚硫酸根离子等;
D.二氧化硫、乙醇也能被酸性高锰酸钾溶液氧化.
解答 解:A.非金属性强弱判据之一是:最高价氧化物对应水化物的酸性强弱,盐酸不是最高价含氧酸,故A错误;
B.Na2SO3溶液能与Br2反应而吸收Br2,Na2SO3溶液的碱性弱于NaOH溶液,可防止C2H5Br水解,故B正确;
C.能和氯化钡溶液反应生成不溶于稀硝酸的离子有银离子、钡离子、亚硫酸根离子等,有Ag+或SO32-等离子的干扰,故C错误;
D.乙醇与浓H2SO4混合加热,可发生副反应生成SO2等物质,也能使酸性KMnO4溶液褪色,且乙醇也能使酸性高锰酸钾溶液褪色,故D错误;
故选B.
点评 本题考查化学实验方案评价,为高考高频点,明确实验原理是解本题关键,注意A中不能根据氢化物的酸性强弱判断非金属性强弱,注意D中生成的乙烯中含有杂质成分及其性质,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.Cl2是一种重要的化工原料.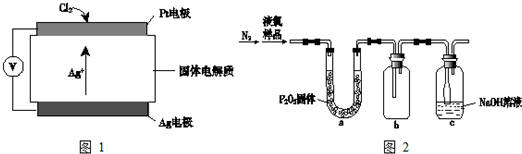
(1)电解饱和NaCl溶液获得Cl2的化学方程式是2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+OH-
(2)为便于储存,要将氯气液化[Cl2(g)?Cl2(l)],应采取的措施是加压或降温(写出一条即可).
(3)液氯储存区贴有的说明卡如下(部分):
①用离子方程式表示“泄漏处理”中NaHSO3溶液的作用HSO3-+Cl2+H2O═SO42-+3H++2Cl-
②若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是铁与氯气反应生成的氯化铁,对氯与苯的反应有催化作用
③氯气含量检测仪工作原理示意图如图1:Cl2在Pt电极放电的电极反应式是2Ag++Cl2+2e-=2AgCl↓
(4)质量标准要求液氯含水量(以1g氯气含水的质量计)<0.4mg,含水量超标会严重腐蚀钢瓶.液氯含水量的测定装置如图2所示:(已知:P2O5+3H2O═2H3PO4;Cl2与P2O5不反应.)
用离子方程式说明c装置的作用Cl2+2OH-═Cl-+ClO-+H2O.

(1)电解饱和NaCl溶液获得Cl2的化学方程式是2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+OH-
(2)为便于储存,要将氯气液化[Cl2(g)?Cl2(l)],应采取的措施是加压或降温(写出一条即可).
(3)液氯储存区贴有的说明卡如下(部分):
| 危险性 |  |
| 储运要求 | 远离金属粉末、氨、烃类、醇等物质;设置氯气检测仪 |
| 泄漏处理 | NaOH、NaHSO3溶液吸收 |
| 包装 | 钢瓶 |
②若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是铁与氯气反应生成的氯化铁,对氯与苯的反应有催化作用
③氯气含量检测仪工作原理示意图如图1:Cl2在Pt电极放电的电极反应式是2Ag++Cl2+2e-=2AgCl↓
(4)质量标准要求液氯含水量(以1g氯气含水的质量计)<0.4mg,含水量超标会严重腐蚀钢瓶.液氯含水量的测定装置如图2所示:(已知:P2O5+3H2O═2H3PO4;Cl2与P2O5不反应.)
用离子方程式说明c装置的作用Cl2+2OH-═Cl-+ClO-+H2O.
2.设NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3NA | |
| B. | 将1mol氯气通入足量水中发生反应转移电子数为 NA | |
| C. | 585 g氯化钠晶体中约含有6.02×1022个氯化钠分子 | |
| D. | 常温下,200 ml、0.5 mol•L-1的Na2CO3溶液中阴离子数目等于0.1 NA |
19.下列物质分类正确的是( )
| A. | SO2、SiO2、NO2均为酸性氧化物 | |
| B. | 稀豆浆、鸡蛋清溶液、氯化铁溶液均为胶体 | |
| C. | 烧碱、冰醋酸、甲苯均为电解质 | |
| D. | 福尔马林、水玻璃、氨水均为混合物 |
6.某小组为研究电化学原理,设计如图装置(4mol•L-1CuSO4溶液1L),下列叙述不正确的是( )


| A. | a和b不连接时,铁片上会有金属铜析出 | |
| B. | a和b用导线连接时,碳棒上发生的反应为:Cu2++2e-═Cu | |
| C. | 无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色 | |
| D. | a和b分别连接直流电源正、负极,在电路中通过0.5mol电子后反接,又通过1mol电子,此时溶液中的c(H+)是2mol•L-1(假定溶液体积不变) |
16.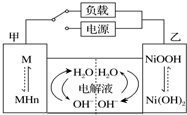 发展混合动力车是实施节能减排的重要措施之一.汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态以节省能耗.混合动力车的电动机目前一般使用的是镍氢电池,镍氢电池采用镍的化合物为正极,储氢金属(以M表示)为负极,电解液为碱液(主要为KOH)(见图).镍氢电池充放电原理总反应式为:H2+2NiOOH$?_{充电}^{放电}$2Ni(OH)2.下列有关混合动力车的判断正确的是( )
发展混合动力车是实施节能减排的重要措施之一.汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态以节省能耗.混合动力车的电动机目前一般使用的是镍氢电池,镍氢电池采用镍的化合物为正极,储氢金属(以M表示)为负极,电解液为碱液(主要为KOH)(见图).镍氢电池充放电原理总反应式为:H2+2NiOOH$?_{充电}^{放电}$2Ni(OH)2.下列有关混合动力车的判断正确的是( )
 发展混合动力车是实施节能减排的重要措施之一.汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态以节省能耗.混合动力车的电动机目前一般使用的是镍氢电池,镍氢电池采用镍的化合物为正极,储氢金属(以M表示)为负极,电解液为碱液(主要为KOH)(见图).镍氢电池充放电原理总反应式为:H2+2NiOOH$?_{充电}^{放电}$2Ni(OH)2.下列有关混合动力车的判断正确的是( )
发展混合动力车是实施节能减排的重要措施之一.汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态以节省能耗.混合动力车的电动机目前一般使用的是镍氢电池,镍氢电池采用镍的化合物为正极,储氢金属(以M表示)为负极,电解液为碱液(主要为KOH)(见图).镍氢电池充放电原理总反应式为:H2+2NiOOH$?_{充电}^{放电}$2Ni(OH)2.下列有关混合动力车的判断正确的是( )| A. | 在刹车和下坡时,甲电极的电极反应式为:H2+2OH--2e-═2H2O | |
| B. | 在上坡或加速时,甲电极周围溶液的pH将减小 | |
| C. | 在上坡或加速时,溶液中的K+向甲电极迁移 | |
| D. | 在刹车和下坡时,乙电极增重 |
20.下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将干燥纯净的氯气通入装有湿润的红色纸条的试剂瓶中 | 红色褪去 | 氯气有漂白性 |
| B | 往乙醇中加入适量浓硫酸制备乙烯,并将产生的气体直接通入酸性KMnO4溶液中 | 酸性KMnO4溶液紫红色褪去 | 证明乙烯能被酸性高锰酸钾氧化 |
| C | 取少量BaSO4固体于试管中,加入足量的盐酸 | 沉淀不溶解 | BaSO4不溶于盐酸,且可以用盐酸和BaCl2溶液检验SO42- |
| D | 在分液漏斗中加入碘水后再加入苯,充分振荡 | 分层,且上层溶液呈紫色 | 苯可作为碘的萃取剂 |
| A. | A | B. | B | C. | C | D. | D |
1.安全是顺利进行实验的保障,下列实验处理或方法正确的是( )
| A. | 利用蒸馏分离有机物时,明火尽量与接液器保持一定距离 | |
| B. | 做焰色反应实验时,铂丝需要在硫酸中蘸洗 | |
| C. | 实验室制取氨气时,收集装置必须洗净但无需干燥 | |
| D. | 甲烷与氧气反应时,需要黑纸遮挡避免灯光照射 |
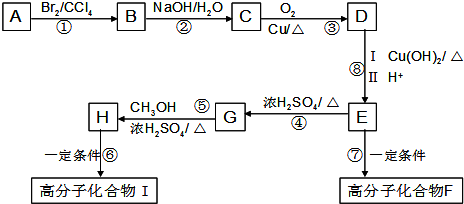
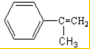 (2)E中的官能团名称是羟基、羧基
(2)E中的官能团名称是羟基、羧基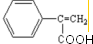 (4)反应②、④的反应类型分别是取代反应、消去反应
(4)反应②、④的反应类型分别是取代反应、消去反应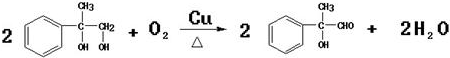 ;反应⑦n
;反应⑦n $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$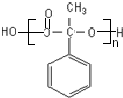 +(n-1)H2O;
+(n-1)H2O;