题目内容
【题目】工业合成氨是解决人类的生存问题。回答下列问题:
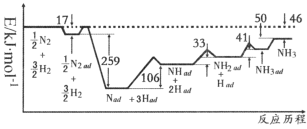
(1)科学家研究利用铁触媒催化合成氨的反应历程如图所示,其中吸附在催化剂表面的物种用“ad”表示,对图中线间距离窄小的部分,其能量差用![]() 的方式表示。由图可知合成氨反应N2(g)+3H2(g)
的方式表示。由图可知合成氨反应N2(g)+3H2(g)![]() 2NH3(g)的
2NH3(g)的![]() =_______kJ·mol-1,反应速率最慢的步骤的化学方程式为____________。
=_______kJ·mol-1,反应速率最慢的步骤的化学方程式为____________。
(2)工业合成氨反应为:N2(g)+3H2(g) ![]() 2NH3(g),当进料体积比V(N2):V(H2)=1:3时,平衡气体中NH3的物质的量分数随温度和压强变化的关系如图所示:
2NH3(g),当进料体积比V(N2):V(H2)=1:3时,平衡气体中NH3的物质的量分数随温度和压强变化的关系如图所示:
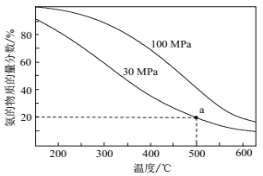
则500℃时:
①平衡常数KP(30MPa)________KP(100MPa)。(填“<”、“=”、“>”)
②30MPa时,氢气的平衡转化率为_________(结果保留3位有效数字)。用平衡分压表示平衡常数KP=_______________(列出计算式即可,不必化简)。
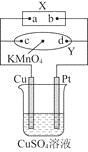
(3)科学家利用电解法在常温常压下实现合成氨,工作时阴极区的微观反应过程如图所示,其中电解液为溶解有三氟甲磺酸锂和乙醇的有机溶液。
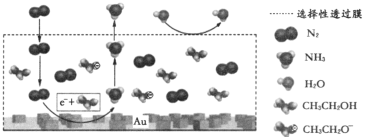
①阴极区生成NH3的电极反应式为_____________。
②下列说法正确的是_______________(填标号)。
A.三氟甲磺酸锂的作用是增强导电性
B.选择性透过膜可允许N2和NH3通过,防止H2O进入装置
C.保持电流强度不变,升高溶液的温度,可以加快电解反应的速率
【答案】-92 Nad+3HadNHad + 2Had = 33.3%  N2+6e-+6C2H5OH=2NH3+6C2H5O- AB
N2+6e-+6C2H5OH=2NH3+6C2H5O- AB
【解析】
(1)由图可知,反应物[![]() N2(g)+
N2(g)+![]() H2(g)]和生成物[NH3(g)]的能量差为46 kJ·mol-1;反应的活化能越大,破坏化学键消耗能量越大,反应速率越慢,由图可知,(Nad+3Had)转化为(NHad + 2Had)时,反应物破坏化学键消耗能量最大;
H2(g)]和生成物[NH3(g)]的能量差为46 kJ·mol-1;反应的活化能越大,破坏化学键消耗能量越大,反应速率越慢,由图可知,(Nad+3Had)转化为(NHad + 2Had)时,反应物破坏化学键消耗能量最大;
(2)①化学平衡常数是温度函数,只受温度变化的影响;
②由题意建立三段式求解可得;
(3)①从阴极区的微观反应过程示意图可知,N2与C2H5OH在阴极区得到电子发生还原反应生成NH3和C2H5O-;
②A.三氟甲磺酸锂电离出离子,使溶液中离子浓度增大,增强溶液导电性;
B.从示意图可知,水在选择性透过膜上方;
C.保持电流恒定,升高温度不改变电解反应速率。
(1)由图可知,反应物[![]() N2(g)+
N2(g)+![]() H2(g)]和生成物[NH3(g)]的能量差为46 kJ·mol-1,合成氨反应
H2(g)]和生成物[NH3(g)]的能量差为46 kJ·mol-1,合成氨反应![]() N2(g)+
N2(g)+![]() H2(g)
H2(g)![]() NH3(g)的H=—46 kJ·mol-1,则N2(g)+3H2(g)
NH3(g)的H=—46 kJ·mol-1,则N2(g)+3H2(g)![]() 2NH3(g)的
2NH3(g)的![]() =2×(—46 kJ·mol-1)=—92kJ·mol-1;反应的活化能越大,破坏化学键消耗能量越大,反应速率越慢,由图可知,(Nad+3Had)转化为(NHad + 2Had)时,反应物破坏化学键消耗能量最大,则反应速率最慢,反应的化学方程式为Nad+3HadNHad + 2Had,故答案为:—92;Nad+3HadNHad + 2Had;
=2×(—46 kJ·mol-1)=—92kJ·mol-1;反应的活化能越大,破坏化学键消耗能量越大,反应速率越慢,由图可知,(Nad+3Had)转化为(NHad + 2Had)时,反应物破坏化学键消耗能量最大,则反应速率最慢,反应的化学方程式为Nad+3HadNHad + 2Had,故答案为:—92;Nad+3HadNHad + 2Had;
(2)①化学平衡常数是温度函数,只受温度变化的影响,则500℃时,反应平衡常数Kp(30MPa)=Kp(100MPa),故答案为:=;
②设参加反应N2的物质的量为x,由题意建立如下三段式:
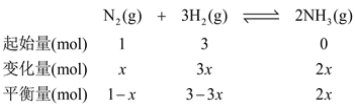
由图可知,氨气的物质的量分数为20%,则由三段式可得![]() ,解得x=
,解得x=![]() ,则氢气的平衡转化率为
,则氢气的平衡转化率为![]() =33%;由三段式数据可得N2的体积分数为
=33%;由三段式数据可得N2的体积分数为![]() =20%,H2的体积分数为
=20%,H2的体积分数为![]() =60%,则用平衡分压表示平衡常数Kp=
=60%,则用平衡分压表示平衡常数Kp=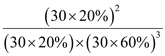 ,故答案为:33%;
,故答案为:33%;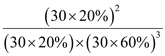 ;
;
(3)①从阴极区的微观反应过程示意图可知,N2与C2H5OH在阴极区得到电子发生还原反应生成NH3和C2H5O-,电极反应式为N2+6e-+6C2H5OH=2NH3+6C2H5O-,故答案为:N2+6e-+6C2H5OH=2NH3+6C2H5O-;
②A.从阴极反应看,电解液为溶解有三氟甲磺酸锂和乙醇的有机溶液,三氟甲磺酸锂并未参与反应,作用是电离出离子,使溶液中离子浓度增大,增强溶液导电性,A正确;
B.从示意图可知,水在选择性透过膜上方,说明选择性透过膜可允许N2和NH3通过,不允许H2O透过,B正确;
C.保持电流恒定,升高温度不改变电解反应速率,C错误;
AB正确,故答案为:AB。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】用如图所示装置测定镁带样品中单质镁的质量分数。(杂质与酸反应不产生气体)
完成下列填空:
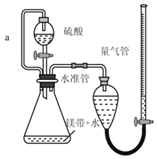
(1)硫酸必须过量的目的是_____
(2)导管a的作用是_____
(3)取两份镁带样品分别进行实验,所得数据见下表:
实验次数 | 镁带质量(g) | 氢气体积(mL)(已换算成标准状况) |
1 | 0.053 | 44.60 |
2 | 0.056 | 47.05 |
单质镁的质量分数是_____。(保留3位小数)
(4)如果测定结果偏高,可能的原因是_____。(选填编号)
a.装置漏气
b.未冷却至室温即读数
c.镁带中含有氧化镁
d.末读数时量气管的液面低于水准管